Erste Gentherapie der kompletten Farbenblindheit auf klinische Sicherheit erprobt

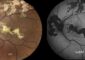
Buntes Blumenbeet, wie es Normalsichtige wahrnehmen, scharf und in Farbe. Foto und Simulation: Stylianos Michalakis
Bei kompletter Farbenblindheit können Menschen von Geburt an keine Farben unterscheiden, leiden aber auch unter einer stark reduzierten Sehschärfe und hoher Blendungsempfindlichkeit.
Ursache ist ein Defekt an den Zapfen-Lichtrezeptoren in der Netzhaut des Auges, die für das Sehen im Tageslicht und von Farben zuständig sind. Von der kompletten Farbenblindheit, die auch als Achromatopsie bezeichnet wird, sind in Deutschland rund 3.000 Menschen betroffen. Die Achromatopsie kann bisher nicht ursächlich behandelt werden.
Bei etwa einem Drittel der Achromatopsie-Patientinnen und -Patienten liegt der Defekt im CNGA3-Gen. Für diesen Gendefekt hat ein Team des Forschungsinstituts für Augenheilkunde des Universitätsklinikums Tübingen und der Departments für Pharmazie und Ophthalmologie der Ludwig-Maximilians-Universität München eine gentherapeutische Behandlung entwickelt.
Bei der Gentherapie wird die gesunde Version des CNGA3-Gens über ein harmloses Virus direkt in die Netzhaut der Patienten eingeschleust. Nach einigen Wochen können die Netzhautzellen die gesunde Version des CNGA3-Gens nutzen und das entsprechende intakte Protein bilden, das die Funktion der defekten Zapfen wiederherstellen soll.
Die dabei verwendeten Genfähren, sogenannte Adeno-assoziierte Viren, wurden an der Ludwig-Maximilians-Universität München von Professor Stylianos Michalakis und Professor Martin Biel entwickelt.
An der Universitäts-Augenklinik Tübingen ist nun die erste klinische Studie zu dieser Therapie am Menschen abgeschlossen worden. Sie wird in der Fachzeitschrift JAMA Ophthalmology der American Medical Association veröffentlicht. In der Studie wurde in der Universitätsaugenklinik in Tübingen das jeweils schlechtere Auge von neun Achromatopsie-Patienten im Alter von 24 bis 59 Jahren operativ durch Injektion des gentherapeutischen Wirkstoffes unter die Netzhaut behandelt.
„Die Probanden hatten in der Folge keine wirkstoffbezogenen Gesundheitsprobleme, und ihre Netzhaut wies keine dauerhaften Veränderungen auf“, berichtet Professor Dominik Fischer, der Leiter der klinischen Studie. Das Hauptanliegen dieser ersten klinischen Studie sei damit erreicht, die Behandlung könne als sicher eingestuft werden. Auch bei der Wirksamkeit sei ein deutlich positiver Effekt zu verzeichnen. Die visuelle Funktion der Patienten habe sich etwas verbessert, sowohl bei der Sehschärfe als auch beim Kontrast- und Farbensehen.
„Die jetzt durchgeführte Studie ist ein wichtiger erster Schritt und Meilenstein hin zu einer kurativen Therapie der Achromatopsie, und wir erwarten noch bessere Behandlungserfolge in der Zukunft“, sagt Professor Bernd Wissinger vom Tübinger Forschungsinstitut für Augenheilkunde, der gemeinsam mit Professor Martin Biel vom Department Pharmazie der Ludwig-Maximilians-Universität München das RD-CURE-Gesamtprojekt zur Entwicklung der Gentherapie bei erblichen Netzhauterkrankungen leitet.
Aus Sicherheitsgründen waren die behandelten neun Patienten im Erwachsenenalter und wiesen damit eine bereits mehr oder minder stark vorgeschädigte Netzhaut auf. „Zudem verlieren die das Sehen verarbeitenden Anteile des Gehirns im Erwachsenenalter zunehmend an Plastizität“, wie Professor Marius Ueffing, Direktor des Forschungsinstituts für Augenheilkunde, betont.
„Da das Gehirn von Achromatopsie-Betroffenen nie gelernt hat, Farbsehen zu verarbeiten, ist diese Plastizität eine notwendige Voraussetzung dafür, die neugewonnene Farbsehfähigkeit der Netzhaut in einen echten Seheindruck umzusetzen.“ Da die Studie gezeigt hat, dass die Therapie sicher ist, könnte es daher in Zukunft angezeigt sein, Betroffene so früh zu behandeln, dass eine hohe Plastizität des Gehirns und eine noch nicht vorgeschädigte Netzhaut den Behandlungserfolg vergrößern können.
Nach Einschätzung der Wissenschaftler sollte daher die neue Gentherapie analog zum kürzlich zugelassenen Gentherapiemedikament Luxturna bereits im Kindesalter durchgeführt werden, um die bestmögliche Wirkung zu entfalten. „Da sich die verwendeten Genvektoren als sicher erwiesen haben, ist eine Folgestudie an pädiatrischen CNGA3-Patienten möglich und sinnvoll“, erläutert Professor Stylianos Michalakis vom Department für Augenheilkunde der Ludwig-Maximilians-Universität München.
Eine Besonderheit: Die gesamte klinische Studie wurde forschungsinitiiert, das heißt ohne industrielle Unterstützung durchgeführt, und das Universitätsklinikum Tübingen trug die Verantwortung als Sponsor. Alle regulatorischen und organisatorischen Aufgaben übernahm die Studienzentrale STZ eyetrial am Department für Augenheilkunde unter der Leitung von Professorin Barbara Wilhelm.
„Diese Studie ist das Ergebnis einer seit vielen Jahre bestehenden und sehr erfolgreichen Kooperation zwischen Tübingen und München“, betont Professor Martin Biel. „Wir sind stolz darauf, dass diese weltweit erste erfolgreiche Gentherapie bei der Achromatopsie mit Unterstützung durch die Tistou und Charlotte Kerstan Stiftung hier in Deutschland entwickelt und durchgeführt werden konnte“, sagen Professor Karl-Ulrich Bartz-Schmidt und Professor Marius Ueffing, die beiden Direktoren des Tübinger Departments für Augenheilkunde.
„Und wir schätzen den Weitblick unseres Vorgängers Professor Eberhart Zrenner, Augenarzt und Gründungsdirektor des Tübinger Forschungsinstituts für Augenheilkunde, der den Forschungsschwerpunkt Erbliche Netzhautdystrophien bereits 1989 dort aufgebaut hat.“
Vor wenigen Tagen erhielt das Department für Augenheilkunde vom Bundesministerium für Bildung und Forschung die Zusage für die Finanzierung einer von Dr. Tobias Peters, STZ eyetrial, geleiteten Folgestudie, in der die Behandlung von Kindern und die Anwendung des Vektors in beiden Augen vorgesehen ist. Auf dem Weg zu einer optimalen Therapie der CNGA3-Achromatopsie geht es also weiter.
Universitätsklinikum Tübingen
Forschungsinstitut für Augenheilkunde
Molekulargenetisches Labor
Prof. Dr. Bernd Wissinger
Elfriede-Aulhorn-Straße 7, 72076 Tübingen
Tel. 07071 29-85032 ,Fax 07071 29-5725
E-Mail wissinger[at]uni-tuebingen.de
Ludwig-Maximilians-Universität München
Ocular Gene Therapy Group
Department of Ophthalmology
Prof. Dr. Stylianos Michalakis
Mathildenstraße 8, 80336 München
E-Mail michalakis[at]lmu.de
Ludwig-Maximilians-Universität München
Department of Pharmacy-Chair of Pharmacology
Prof. Dr. Martin Biel
Butenandtstr. 5-13, 81377 München
E-Mail biel[at]lmu.de
Fischer, M.D., Michalakis, S., et al.: Safety and Vision Outcomes of Subretinal Gene Therapy Targeting Cone Photoreceptors in Achromatopsia – A Nonrandomized Controlled Trial. JAMA Ophthalmology, https://dx.doi.org/10.1001/jamaophthalmol.2020.1032
Media Contact
Alle Nachrichten aus der Kategorie: Medizin Gesundheit
Dieser Fachbereich fasst die Vielzahl der medizinischen Fachrichtungen aus dem Bereich der Humanmedizin zusammen.
Unter anderem finden Sie hier Berichte aus den Teilbereichen: Anästhesiologie, Anatomie, Chirurgie, Humangenetik, Hygiene und Umweltmedizin, Innere Medizin, Neurologie, Pharmakologie, Physiologie, Urologie oder Zahnmedizin.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…