Entschlüsselt: Signalweg, der zu Lungenhochdruck führt
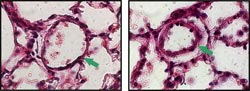
Links: Arterie mit dünner Gefäßwand (Pfeil) in einer Mauslunge, die normaler Raumluft ausgesetzt war. Rechts: Arterie mit dicker Gefäßwand (Pfeil) unter Sauerstoffmangel-Bedingungen.<br><br>Foto: Dr. Michaela Matthey/Uni Bonn<br>
Wissenschaftler der Universität Bonn haben jetzt einen Signalweg entschlüsselt, der die Gefäßverengung in der Lunge unter Sauerstoffmangel verursacht. Der entdeckte Mechanismus bietet einen potenziellen Ansatzpunkt für neue Medikamente. Die Ergebnisse werden nun in den “Proceedings of the National Academy of Sciences” (PNAS) vorgestellt.
Die Lunge ist ein sehr effizientes Organ: Nur dort, wo die Belüftung der Lungenbläschen gut ist, fließt das Blut hin, und dort findet auch vermehrt der Sauerstoffübertritt ins Blut statt. Wenn ein Lungenbläschen dagegen nicht so gut belüftet ist, verengen sich die benachbarten Gefäße und drosseln den Blutzufluss.
„Das funktioniert ganz nach dem Prinzip »Nur dort Energie investieren, wo es sich lohnt«“, sagt Dr. Daniela Wenzel vom Institut für Physiologie I der Universität Bonn. Dass es durch mangelnde Ventilation in einem Teil der Lunge zu einem lokalen Sauerstoffmangel kommt und sich daraufhin die Blutgefäße verengen, ist schon seit Langem bekannt. „Unklar ist, welche Mechanismen dabei eine Rolle spielen“, berichtet Dr. Michaela Matthey, eine der Erstautorinnen der Studie.
Einen neuen Signalweg, der vom Sauerstoffmangel zur Gefäßverengung in der Lunge führt, haben nun Wissenschaftler des Instituts für Physiologie I und des Instituts für Molekulare Psychiatrie des Life & Brain Zentrums der Universität Bonn zusammen mit dem Institut für Physiologische Chemie des Universitätsklinikums Mainz entschlüsselt. Sinkt der Sauerstoffgehalt in den Gefäßen, die das Lungenbläschen umgeben, bildet sich vermehrt Arachidonylethanolamid (AEA), ein vom Körper produziertes Cannabinoid. Es wird daraufhin durch das Enzym FAAH zu Lipidmediatoren verstoffwechselt, die direkt für die Gefäßverengung verantwortlich sind.
Forscher blockieren schrittweise die Schalter des Signalwegs
Den Signalweg entdeckten die Wissenschaftler, indem sie in so genannten Knockout-Mäusen das Gen für das Enzym FAAH stumm schalteten und damit die Signalkette unterbrachen. Trotz des Sauerstoffmangels stieg der Druck in den Lungengefäßen kaum an. „Das Enzym FAAH musste also eine Schlüsselrolle spielen“, berichtet Dr. Wenzel. Nach diesem Muster blockierten die Forscher nacheinander die einzelnen Schalter des vermuteten Signalwegs. Jedes Mal blieb ein deutlicher Druckanstieg in den Lungengefäßen der Mäuse aus. „Das zeigte uns, dass wir die wichtigen Bestandteile der Signalkette erfasst haben“, sagt die Wissenschaftlerin der Universität Bonn.
Potenzielle Ansatzpunkte für Medikamente gegen Lungenhochdruck
Das Forscherteam konnte darüber hinaus unter anderem mit massenspektrometrischen Messungen an menschlichen Zellen aufklären, dass die glatten Muskelzellen der Lungengefäße für die Gefäßverengung verantwortlich sind. „Bei einem Sauerstoffmangel wird in genau diesen Zellen mehr AEA produziert, das die Ausgangssubstanz der Signalkette ist“, sagt Dr. Matthey. Die Resultate aus der Grundlagenforschung bieten interessante potenzielle Ansatzpunkte zur Behandlung von Lungenhochdruck, unter dem zum Beispiel starke Raucher leiden können.
Bei dieser Krankheit verengen sich dauerhaft die Lungengefäße, die Gefäßmuskulatur verdickt sich und wird mit Bindegewebe durchsetzt. Dadurch steigt unumkehrbar der Druck in den Lungengefäßen. Die rechte Herzkammer muss gegen den Lungenhochdruck immer stärker arbeiten und erschöpft allmählich. Ohne Therapie beträgt die durchschnittliche Lebenserwartung nur wenige Jahre. „Der Lungenhochdruck lässt sich bislang nicht heilen, sondern nur abmildern“, sagt Dr. Wenzel. Die Forscher haben bereits im Mausmodell gezeigt, dass ein Hemmstoff, der das Enzym FAAH als Schlüsselmolekül in der Signalkette blockiert, die Ausbildung von Lungenhochdruck verhindern kann. „Allerdings besteht noch weiterer Forschungsbedarf, ob dieser Wirkstoff auch für den Menschen in Frage kommt“, sagt Prof. Dr. Bernd Fleischmann vom Institut für Physiologie.
Die Studie wurde durch die DFG im Rahmen der Forschergruppe 926 „Physiology and Pathophysiology of the endocannabinoid system“ gefördert.
Publikation: Endocannabinoid anandamide mediates hypoxic pulmonary vasoconstriction, Proceedings of the National Academy of Sciences (PNAS), DOI: 10.1073/pnas.1308130110.
Kontakt:
Dr. med. Daniela Wenzel
Institut für Physiologie I
Universität Bonn
Life & Brain Center
Tel.: 0228/6885-216
E-Mail: dwenzel@uni-bonn.de
Media Contact
Weitere Informationen:
http://www.uni-bonn.deAlle Nachrichten aus der Kategorie: Medizin Gesundheit
Dieser Fachbereich fasst die Vielzahl der medizinischen Fachrichtungen aus dem Bereich der Humanmedizin zusammen.
Unter anderem finden Sie hier Berichte aus den Teilbereichen: Anästhesiologie, Anatomie, Chirurgie, Humangenetik, Hygiene und Umweltmedizin, Innere Medizin, Neurologie, Pharmakologie, Physiologie, Urologie oder Zahnmedizin.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…