Wie die „Qualitätskontrolle“ bei der Montage eines Ribosoms funktioniert
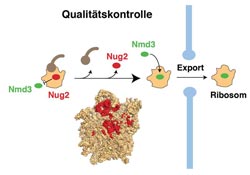
Qualitätskontrolle und Export des Ribosoms aus dem Zellkern in das Zytoplasma (schematische Darstellung)<br><br>Abbildung: Ed Hurt<br>
Ähnlich wie bei der Montage eines Fahrzeugs müssen sich die aus vielen Einzelteilen zusammengesetzten Ribosomen nach ihrem Zusammenbau einer „Qualitätskontrolle“ unterziehen. Erst dann können sie an ihren Bestimmungsort gebracht werden und dort ihre eigentliche Aufgabe – die Herstellung von Proteinen in der Zelle – übernehmen.
Einen wichtigen Bestandteil dieses Kontrollprozesses hat jetzt ein Wissenschaftlerteam am Biochemie-Zentrum der Universität Heidelberg untersucht. Die Forscher um Prof. Dr. Ed Hurt konnten zeigen, dass ein spezielles Protein, das von der Hefe bis zum Menschen in allen Zellen vorkommt, wie ein molekularer Kontrollschalter funktioniert und so verhindert, dass unvollständige Ribosomen die „Montagehalle“ verlassen. Die Ergebnisse ihrer Untersuchungen wurden in der Fachzeitschrift „Nature“ veröffentlicht.
Ribosomen sind makromolekulare Komplexe, die aus einer Vielzahl von Bestandteilen bestehen. Dies sind Ribonukleinsäuren und ribosomale Proteine, die in einer speziellen dreidimensionalen Struktur arrangiert sind. Die korrekte Ribosomenherstellung ist von entscheidender Bedeutung für das Überleben aller Zellen. Ihr Zusammenbau ist ein nach strengen Regeln ablaufender Prozess, der der Montage eines Autos aus vielen Einzelteilen am Fließband ähnelt. Bevor das komplett montierte Fahrzeug die Montagehalle verlassen kann, wird seine volle Funktionstüchtigkeit geprüft, um dann an seinem Bestimmungsort zum Einsatz gebracht zu werden.
Wie diese „Qualitätskontrolle“ bei der Ribosomenherstellung abläuft, ist nach den Worten von Prof. Hurt bislang nur wenig erforscht. Die Heidelberger Wissenschaftler haben jetzt die Funktion eines Proteins aus der Familie der energie-verbrauchenden GTPasen in diesem Kontrollprozess entschlüsselt.
Nur Ribosomen, die korrekt zusammengebaut wurden, gelangen von ihrer „Montagehalle“ im Zellkern in das Zytoplasma, wo sie ihre eigentliche Aufgabe, die Synthese von Proteinen, erledigen. Der Export ins Zytoplasma ist abhängig davon, dass eine bestimmte Kontrollschranke überwunden wird. Dabei kommt der Exportfaktor Nmd3 zum Einsatz, der an das neu entstehende Ribosom bindet. Dazu muss das Signal gegeben werden, dass der Zusammenbau des Ribosoms richtig und vollständig erfolgt ist. Bis dahin aber bleibt der Ort, der für die Bindung des Exportvermittlers Nmd3 vorgesehen ist, durch eine Art „Kontrolleur“ besetzt.
Wie das Heidelberger Forscherteam zeigen konnte, übernimmt diese Funktion ein Mitglied aus der Proteinfamilie der GTPasen, das den Namen Nug2 trägt. Erst wenn ein spezielles Enzym in Aktion tritt, um das Ribosom am Ende der „Montage“ auf den Export in das Zytoplasma vorzubereiten und dabei die von der GTPase gespeicherte Energie verbraucht, verlässt der Kontrolleur Nug2 seinen Platz und macht den Weg frei für die Bindung des Exportfaktors Nmd3. Auf diese Weise wird der Export unvollständig zusammengebauter Ribosomen verhindert.
Nachdem das Team um Prof. Hurt entschlüsseln konnte, welche Rolle der Kontrolleur Nug2 bei der Ribosomenherstellung übernimmt, erhoffen sich die Forscher nun weitere Erkenntnisse über die Funktion verwandter Proteine. Diese sogenannten Nukleostemine sind bei höheren Eukaryoten einschließlich des Menschen zu finden. Dabei wollen die Heidelberger Wissenschaftler die molekularen Mechanismen entschlüsseln, mit denen verschiedene Enzyme aus der Nukleostemin-Familie die beiden grundlegenden zellulären Prozesse der Bildung von Ribosomen und der Vermehrung von Zellen verbinden. Kooperationspartner der aktuellen Forschungsarbeiten waren Wissenschaftler der University of Edinburgh (Großbritannien).
Informationen im Internet:
Forschergruppe Prof. Dr. Ed Hurt: http://www.uni-heidelberg.de/zentral/bzh/hurt
Biochemie-Zentrum der Universität Heidelberg: http://www.bzh.uni-heidelberg.de
Originalpublikation:
Y. Matsuo, S. Granneman, M. Thoms, R.-G. Manikas, D. Tollervey and E. Hurt: Coupled GTPase and remodeling ATPase activities form a checkpoint for ribosome export, Nature (17 November 2013), doi: 10.1038/nature12731
Kontakt:
Prof. Dr. Ed Hurt
Biochemie-Zentrum der Universität Heidelberg
Telefon (06221) 54-4173
ed.hurt@bzh.uni-heidelberg.de
Kommunikation und Marketing
Pressestelle, Telefon (06221) 54-2311
presse@rektorat.uni-heidelberg.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Anlagenkonzepte für die Fertigung von Bipolarplatten, MEAs und Drucktanks
Grüner Wasserstoff zählt zu den Energieträgern der Zukunft. Um ihn in großen Mengen zu erzeugen, zu speichern und wieder in elektrische Energie zu wandeln, bedarf es effizienter und skalierbarer Fertigungsprozesse…

Ausfallsichere Dehnungssensoren ohne Stromverbrauch
Um die Sicherheit von Brücken, Kränen, Pipelines, Windrädern und vielem mehr zu überwachen, werden Dehnungssensoren benötigt. Eine grundlegend neue Technologie dafür haben Wissenschaftlerinnen und Wissenschaftler aus Bochum und Paderborn entwickelt….

Dauerlastfähige Wechselrichter
… ermöglichen deutliche Leistungssteigerung elektrischer Antriebe. Überhitzende Komponenten limitieren die Leistungsfähigkeit von Antriebssträngen bei Elektrofahrzeugen erheblich. Wechselrichtern fällt dabei eine große thermische Last zu, weshalb sie unter hohem Energieaufwand aktiv…





















