Evolution von Signalmolekülen schafft neue Ansätze für die Sepsis-Therapie
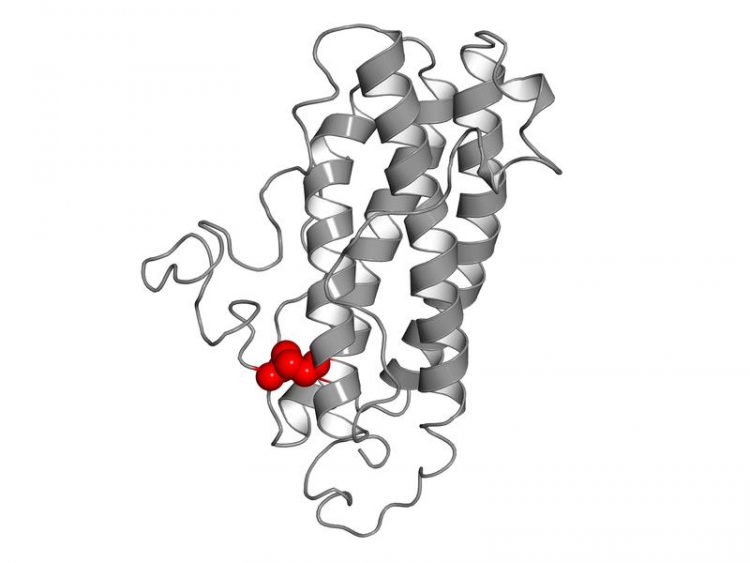
Nach dem Vorbild des Botenstoffs Interleukin-27-alpha der Maus verändertes Interleukin-27-alpha des Menschen. Der Austausch einer Aminosäure ermöglicht die Ausbildung einer Disulfid-Brücke (rot) Bild: Prof. Dr. M. Feige / TUM
Die Zahlen sind alarmierend: Nach Schätzungen der Weltgesundheitsorganisation WHO kommen jährlich sechs Millionen Menschen durch Sepsis ums Leben. Die im Volksmund „Blutvergiftung“ genannte Krankheit beginnt meist mit einer harmlosen Infektion.
Führt diese zu einer überschießenden Reaktion des Immunsystems, kann körpereigenes Gewebe angegriffen und geschädigt werden. Die Überreaktion führt schließlich zu einer lebensbedrohlichen Erschöpfung der körpereigenen Abwehr.
Allein in Deutschland sterben mehr Menschen an Sepsis als an AIDS, Darm- und Brustkrebs zusammen.
Weltweit suchen Forscher nach geeigneten Therapien – bisher vergeblich. Einem interdisziplinären Team aus den Bereichen Strukturbiologie, Immunologie und Zellbiologie ist es jetzt erstmals gelungen, ein Protein herzustellen, das die Reaktion der Immunzellen bändigen kann.
Die Sprache der Botenstoffe
Bei ihrer Entwicklung wurden die Forscherinnen und Forscher inspiriert durch die Evolution. Mäuse beispielsweise sind durch ihr Immunsystem gut vor Sepsis geschützt. Eine Schlüsselrolle spielen dabei die Interleukine, Botenstoffe, welche die Kommunikation zwischen den Zellen des Immunsystems ermöglichen.
„Die Interleukine sind das Vokabular, mit dem Immunzellen kommunizieren“, erklärt Matthias Feige, Professor für Zelluläre Proteinbiochemie an der TU München.
Die Botenstoffe werden von den Zellen nach einem ganz bestimmten Bauplan aus einzelnen Aminosäuren gebildet. Deren Anordnung entscheidet darüber, welche dreidimensionale Struktur ein Interleukin ausbildet und damit welche Informationen es übertragen kann.
Menschen und Mäuse haben dabei ein ähnliches, aber doch unterschiedliches Vokabular. Einen auffälligen Unterschied entdeckten die Forscher beim Interleukin-27-alpha. Dieses kann von Zellen im Immunsystem der Maus – nicht aber von menschlichen Zellen – freigesetzt und zur Kommunikation genutzt werden.
„Mit Hilfe von Computermodellen und zellbiologischen Experimenten konnten wir aufdecken, dass nur eine einzige strukturell wichtige Aminosäure entscheidet, ob Interleukin-27-alpha von Zellen des Immunsystems freigesetzt wird“, erklärt Stephanie Müller, die Erstautorin der Studie „Das brachte uns auf die Idee, wie wir humane Interleukin-Proteine so verändern können, dass sie nun von Zellen freigesetzt werden und wir sie biotechnologisch herstellen können.“
Proteine mit neuen Funktionen aus dem Labor
Das Team stellte daraufhin das modifizierte Interleukin im Labor her und untersuchte es anschließend auf seine biologische Funktion hin. Ergebnis: Der veränderte Botenstoff wird von menschlichen Zellen erkannt.
Immunologische Analysen legen nahe, dass er tatsächlich eine überschießende Reaktion des Immunsystems unterdrücken kann, und damit ein aussichtsreicher Kandidat für eine Sepsis-Therapie ist.
„Damit ist es uns erstmals gelungen, das Vokabular der Botenstoffe zu erweitern und die Reaktion der Immunzellen gezielt zu modulieren. Dies war uns nur durch die enge Zusammenarbeit mit Immunologen und Medizinern der TUM, der Université Sorbonne in Paris und des Helmholtz Zentrums München möglich“, resümiert Feige. Das neue Protein wurde bereits zum Patent angemeldet.
Weitere Informationen:
Gefördert wurde die Forschung durch die Deutsche Forschungsgemeinschaft im Rahmen des Sonderforschungsbereichs SFB 1035 und des Exzellenz-Clusters Center for Integrated Protein Science Munich (CIPSM). Matthias J. Feige ist Rudolf Mößbauer Tenure Track Professor und wird durch das TUM Institute for Advanced Study aus Mitteln der Exzellenzinitiative und der Europäischen Union gefördert.
Weitere Unterstützung kam vom Marie Curie COFUND Programm der Europäischen Union, der Helmholtz Gemeinschaft, der Studienstiftung des Deutschen Volkes sowie der Fondation ARC pour la recherche sur le Cancer und der Ligue Nationale contre le Cancer (Frankreich).
Die Forschungen wurden an der Technischen Universität München am Lehrstuhl für Theoretische Biophysik (Physik Department), im Labor für Zelluläre Proteinbiochemie (Fakultät für Chemie), dem Zentrum Allergie und Umwelt (ZAUM) der TU München und des Helmholtz Zentrums München sowie an der Université Sorbonne in Paris
Prof. Dr. Matthias J. Feige
Technische Universität München
Labor für Zelluläre Proteinbiochemie
Lichtenbergstr. 4, 85748 Garching
Tel.: +49 89 289 13667 – E-Mail: matthias.feige@tum.de
https://www.cell.ch.tum.de
Stephanie I. Müller, Antonie Friedl, Isabel Aschenbrenner, Julia Esser-von Bieren, Martin Zacharias, Odile Devergne, Matthias J Feige:
A folding switch regulates interleukin 27 biogenesis and secretion of its alpha subunit as a cytokine
PNAS, 16.01.2019 – DOI: 10.1073/pnas.1816698116
Link: https://www.pnas.org/content/early/2019/01/15/1816698116
https://www.tum.de/die-tum/aktuelles/pressemitteilungen/detail/article/35210/ Link zur Presseinformation
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Nanofasern befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…





















