Enzyme als Kanalbauer
<br>
In lebenden Systemen beeinflussen komplexe nano- und mikroskopische Strukturen eine Vielzahl von physikalischen und biologischen Funktionen. Während zweidimensionale Muster beispielsweise mit mikrolithographischen Verfahren recht gut nachzuahmen sind, stellen dreidimensionale Strukturen eine große Herausforderung dar.
Amerikanische Forscher berichten jetzt in der Zeitschrift Angewandte Chemie von einer neuen Methode zum lithographiefreien Ätzen komplexer Oberflächen mit bioabbaubaren Polymeren und Enzymen. Ausgehend von strukturierten Mikrokanälen konstruierten sie eine Baueinheit für die Isolierung und Anreicherung von Zellen aus Vollblut.
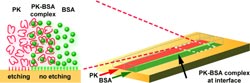
Das Team um Victor M. Ugaz an der Texas A&M University verwendet Proteinase K (PK), ein proteinspaltendes Enzym, das auch den Bio-Kunststoff Polymilchsäure abbauen kann. Auf einen kleinen Block aus Polymilchsäure tragen die Forscher zunächst eine Maske auf, die nur eine schmale Spur freilässt. In diesen Mikrokanal wird eine Flüssigkeit mit PK geleitet. Überall, wo das Enzym mit der Polymilchsäure in Berührung kommt, wird diese „weggeätzt“.
In Mikrokanälen können Flüssigkeiten nebeneinander strömen, ohne sich merklich zu mischen. Dies nutzen die Wissenschaftler zur Herstellung strukturierter Kanälchen. Sie führen rechts und links PK-Lösung durch den Mikrokanal, mittig hemmt eine Proteinlösung den Ätzprozess. Auf diese Weise werden zwei benachbarte Kanälchen in das Polymer geätzt, die durch ein feines „Wehr“ getrennt sind. Im nächsten Schritt wird Proteinlösung sowohl durch einen der geätzten Kanäle als auch über das mittige Wehr geführt, während der zweite Kanal wiederum PK ausgesetzt wird. Damit bleibt der eine Kanal flach, der zweite wird tiefer geätzt. Zum Schluss werden alle drei Spuren mit PKA weiter vertieft. Das Wehr liegt damit niedriger als die „Ufer“ des Doppelkanals.
Ein solcher Doppelkanal wird in Form einer Haarnadelkurve geführt und oben verschlossen. Die Forscher ließen mit Tumorzellen versetztes Blut durch den inneren, flacheren Kanal, Pufferlösung durch den äußeren, tieferen strömen. Fliehkräfte drücken in der Kurve Blutzellen in die äußere Rinne mit dem Puffer. Durch den engen Spalt zwischen Abdeckung und Wehr passen jedoch nur kleine Blutzellen. Die größeren Tumorzellen passen nicht durch und werden im inneren Kanal angereichert, störende rote Blutkörperchen abgereichert. Die unterschiedliche Tiefe beider Kanälchen unterstützt diesen Prozess. Seltene Zellen wie frei zirkulierende Tumorzellen lassen sich auf diese Weise wesentlich rascher und einfacher in Blutproben nachweisen als mit herkömmlichen Methoden, wie der Membranfiltration.
Durch spezielle thermische Vorbehandlung können gezielt kristalline Bereiche in Polymilchsäure erzeugt werden, die von PK nur schlecht abgebaut werden. Auf diese Weise lassen sich Kanälchen mit definierten kleinen Hindernissen erzeugen, die z.B. für Filtrations- oder Chromatographiesysteme geeignet sind.
Angewandte Chemie: Presseinfo 35/2012
Autor: Victor M. Ugaz, Texas A&M University, College Station (USA), http://www.che.tamu.edu/people/faculty/info?fid=11
Angewandte Chemie, Permalink to the article: http://dx.doi.org/10.1002/ange.201204600
Angewandte Chemie, Postfach 101161, 69451 Weinheim, Germany.
Media Contact
Weitere Informationen:
http://presse.angewandte.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















