Bakterien mit Vuvuzela
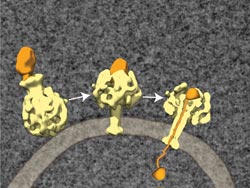
Der Toxin-Komplex besteht aus drei Komponenten: TcA (gelb), TcB und TcC (orange). Der Komplex bindet an einen Rezeptor in der Membran einer Wirtszelle und wird durch Endozytose aufgenommen (links). Eine Änderung des pH-Werts verändert den dreidimensionalen Aufbau: Der zentrale Kanal schiebt sich wie die Kanüle einer Spritze durch die Zellmembran (Mitte). TcB und TcC können so in das Zellinnere gelangen. Dabei wird TcC entpackt und verliert seine ursprüngliche Struktur. <br>© MPI f. molekulare Physiologie/Raunser <br>
Das Bakterium Photorhabdus luminescens ist ein unverzichtbarer Begleiter mancher Fadenwürmer. Diese Würmer befallen Insektenlarven und infizieren sie dabei mit den Bakterien. Die Erreger attackieren die Zellen ihrer Opfer mit einem tödlichen Cocktail aus verschiedenen Giftstoffen.
Wissenschaftler am Max-Planck Institut für molekulare Physiologie in Dortmund haben zusammen mit Kollegen der Universität Freiburg und der Jacobs Universität Bremen herausgefunden, dass ein wichtiger Giftstoff-Komplex der Bakterien wie eine Spritze funktioniert. Er gelangt in von der Zellmembran abgeschnürten Vesikeln in die Wirtszellen und verändert dort seine Struktur. Durch einen Vuvuzela-ähnlichen Proteinkanal dringt dann ein Teil des Giftstoff-Komplexes durch die Membran des Zellbläschens ins Zellinnere ein und tötet die Zelle.
Wichtige Giftstoffe von Photorhabdus luminescens gehören zu den ABC-Toxinen, die aus den drei Proteinkomponenten TcA, TcB und TcC bestehen. Der Toxin-Komplex dockt zunächst an Rezeptormoleküle auf der Membran der Wirtszellen an und wird in kleinen Membranbläschen, sogenannten Vesikeln, ins Innere der Zelle geschleust. Von dort gelangt die TcC-Komponente in die Zellflüssigkeit und zerstört das Proteinskelett der Zelle. Unklar war bislang jedoch, wie das Protein durch die Vesikelmembran hindurch schlüpfen kann.
Die Wissenschaftler konnten nun erstmals mittels Kryo-Elektronenmikroskopie und Einzelpartikelanalyse die Struktur der ABC-Toxine von Photorhabdus luminescens entschlüsseln. Demnach besteht das TcA-Protein des Bakteriums aus fünf Untereinheiten, die zusammen die Form einer Glocke besitzen. „Im Inneren der Glocke bilden die Untereinheiten einen Kanal. Er hat einen breiten und einem schmalen Durchlass und sieht deshalb aus wie das berühmt-berüchtigte Musikinstrument südafrikanischer Fußballfans“, erklärt Stefan Raunser vom Max-Planck-Institut für molekulare Physiologie.
Sobald der pH-Wert in der Umgebung sinkt oder steigt – beispielsweise, wenn die Flüssigkeit in den Vesikeln angesäuert wird – öffnet sich die äußere Hülle des Toxins und gibt den zentralen Kanal frei. „Der Kanal wird nun wie die Kanüle einer Spritze durch die Zellmembran geschoben“, sagt Raunser. TcB und TcC werden in den Bereich zwischen Kanal und Hülle gezogen. Dort wird TcC entpackt und verliert seine ursprüngliche Struktur. „Möglicherweise sind ein Spannungsgefälle oder spezielle Entpackungsproteine wie zum Beispiel TcB notwendig, damit TcC aus dem Vesikel ins Innere der Zelle gelangt und dort seine tödliche Wirkung entfalten kann.“
Die Ergebnisse zeigen, dass das TcA der Fadenwurm-Bakterien eine ähnliche Form besitzt wie Toxine des Pest-Erregers oder anderer Bakterien. „Mit diesen Ergebnissen können wir also möglicherweise auch die Wirkungsweise von Bakterien verstehen, die Krankheiten beim Menschen hervorrufen“, sagt Raunser. Außerdem könnten die Erkenntnisse helfen, schädlingsresistente Nutzpflanzen zu entwickeln.
Neben den ABC-Toxinen haben die Erreger der Pest zusätzlich ein anderes Transportsystem entwickelt, das auch bei den Erregern der Bakterienruhr und Typhus vorkommt. Dieses als Typ-III-Sekretionssystem bezeichnete Sekretionssystem sieht zwar ebenfalls aus wie eine Spritze, allerdings ist der Spritzenkörper in die Bakterienmembran eingebettet und die Spritzennadel weist nach außen. Mit Hilfe dieser Nano-Spritzen können die Bakterien Stoffe direkt in die Wirtszelle injizieren.
Ansprechpartner
Dr. Stefan Raunser,
Max-Planck-Institut für molekulare Physiologie, Dortmund
Telefon: +49 231 133-2356
E-Mail: stefan.raunser@mpi-dortmund.mpg.de
Dr. Peter Herter,
Max-Planck-Institut für molekulare Physiologie, Dortmund
Telefon: +49 231 133-2500
Fax: +49 231 133-2599
E-Mail: peter.herter@mpi-dortmund.mpg.de
Originalpublikation
Christos Gatsogiannis, Alexander E Lang, Dominic Meusch, Vanda Pfaumann, Oliver Hofnagel, Roland Benz, Klaus Aktories, Stefan Raunser
Photorhabdus luminescens toxins use a novel syringe-like injection mechanism for cell entry
Nature, 20.März 2013, DOI: 10.1038/nature11987
Media Contact
Weitere Informationen:
http://www.mpg.de/7027982/bakterien-spritzeAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Ideen für die Zukunft
TU Berlin präsentiert sich vom 22. bis 26. April 2024 mit neun Projekten auf der Hannover Messe 2024. Die HANNOVER MESSE gilt als die Weltleitmesse der Industrie. Ihr diesjähriger Schwerpunkt…

Peptide auf interstellarem Eis
Dass einfache Peptide auf kosmischen Staubkörnern entstehen können, wurde vom Forschungsteam um Dr. Serge Krasnokutski vom Astrophysikalischen Labor des Max-Planck-Instituts für Astronomie an der Universität Jena bereits gezeigt. Bisher ging…

Wasserstoff-Produktion in der heimischen Garage
Forschungsteam der Frankfurt UAS entwickelt Prototyp für Privathaushalte: Förderzusage vom Land Hessen für 2. Projektphase. Wasserstoff als Energieträger der Zukunft ist nicht frei verfügbar, sondern muss aufwendig hergestellt werden. Das…





















