Stoffwechselkrankheiten und Antibiotikaresistenz auf der Spur
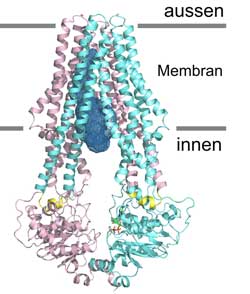
Detailansicht von «TM287/288»: Der Transporter ist nach innen geöffnet. Die beiden unterschiedlichen Proteinketten sind in türkis und pink eingefärbt. Foto: UZH<br>
Biochemikern der Universität Zürich und des NCCR Strukturbiologie ist es gelungen, die atomare Struktur eines neuen Transporters aufzuklären. Die gewonnenen Einsichten könnten zu neuen Therapien führen, beispielsweise gegen multiresistente Bakterien, zystische Fibrose oder Gicht.
ABC-Transporter sind Membranproteine, die aktiv eine Vielzahl an Molekülen durch die Membran pumpen. Mehr als 40 verschiedene ABC-Transporter erfüllen beim Menschen lebensnotwendige Funktionen. Genetische Defekte in ABC-Transportern können zu Stoffwechselkrankheiten führen, wie beispielsweise Gicht, neonatalem Diabetes oder zystischer Fibrose.
Gewisse ABC-Transporter verursachen zudem Resistenzen gegen ein breites Spektrum an Medikamenten. In Tumorzellen werden oft erhöhte Mengen an ABC-Transportern produziert, die Chemotherapeutika aus der Krebszelle herauspumpen. Krebsmedikamente verlieren dadurch ihre Wirkung. Analoge Mechanismen spielen bei vielen pathogenen Bakterien eine entscheidende Rolle: ABC-Transporter befördern Antibiotika aus der Zelle – multiresistente Bakterien sind die Folge.
Trotz ihrer grossen Bedeutung in Biologie und Medizin ist bis anhin nur von wenigen ABC-Transporten die atomare Struktur entschlüsselt. Nun ist es dem Doktoranden Michael Hohl und dem wissenschaftlichen Mitarbeiter Christophe Briand unter der Leitung von Markus Seeger und Prof. Markus Grütter gelungen, die atomare Struktur des neuartigen ABC-Transporters «TM287/288» aufzulösen.
Aufschlussreiche Asymmetrie
Das Membranprotein stammt ursprünglich aus einem wärmeliebenden Bakterium. Im Vergleich zu bereits bekannten Strukturen besitzt «TM287/288» zwei unterschiedliche Proteinketten, die sich zu einem Heterodimer formieren. Etwa die Hälfte der 40 menschlichen ABC-Transporter sind Heterodimere. «Die entdeckten Asymmetrien erlauben es uns, die Funktion von ABC-Transportern neu zu betrachten», erklärt Markus Seeger. «Unsere Resultate könnten längerfristig dazu beitragen, neue Medikamente gegen multiresistente Bakterien oder schwierig zu behandelnde Tumore zu entwickeln. Sie ermöglichen auch neue Ansätze zur Heilung oder Linderung von Erbkrankheiten», schliesst Markus Grütter.
Literatur:
Michael Hohl, Christophe Briand, Markus G. Grütter & Markus A. Seeger. Crystal structure of a heterodimeric ABC transporter in its inward facing conformation. In: Nature Structural & Molecular Biology, 28 March 2012. Doi: 10.1038/nsmb.2267
Kontakte:
Dr. Markus Seeger
Biochemisches Institut
Universität Zürich
Tel. +41 44 635 55 52
E-Mail: m.seeger@bioc.uzh.ch
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















