Fusionsprotein dirigiert Aufbau der Photosynthese-Plattform
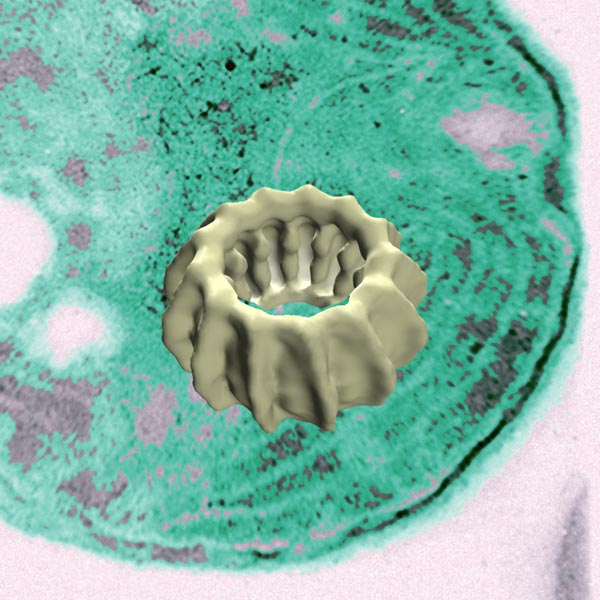
Ein IM30-Ring bindet an interne Membranen. Im Hintergrund ist der Ausschnitt einer elektronenmikroskopischen Aufnahme einer Blaualge zu sehen. Im Vordergrund ist ein 3-D-Modell des IM30-Rings gezeigt. Die Größenverhältnisse sind nicht maßstabsgetreu. Quelle: Dirk Schneider
Chloroplasten sind die Kraftwerke in grünen Pflanzen. In inneren Membranen läuft hier die Photosynthese ab, einer der wichtigsten biologischen Prozesse auf der Erde, bei dem Lichtenergie in chemische Energie und Sauerstoff umgewandelt wird. Obwohl ihre bedeutende Funktion schon lange bekannt ist, war bislang nicht klar, wie es zum Aufbau des innenliegenden, spezifischen Membransystems kommt.
In einem Kooperationsprojekt haben Wissenschaftler der Johannes Gutenberg-Universität Mainz (JGU) nun einen ersten Ansatzpunkt gefunden, wie diese Membranen gebildet werden. Demnach spielt das Protein IM30 eine entscheidende Rolle, indem es eine Fusion interner Membranen anstößt.
An den Untersuchungen über die Bedeutung von IM30 waren Biologen, Chemiker, Biochemiker und Biophysiker der JGU und des Max-Planck-Instituts für Polymerforschung maßgeblich beteiligt. Die Ergebnisse wurden soeben in der Zeitschrift Nature Communications veröffentlicht.
Chloroplasten sind Organellen, die in allen höheren Pflanzen und in Grünalgen vorkommen. Im ihrem Innern befindet sich ein Membransystem, die Thylakoidmembranen, in dem Schlüsselprozesse der Photosynthese ablaufen. „Ein detailliertes Verständnis der Photosynthese und der damit verbundenen molekularen Prozesse ist entscheidend, um unser Leben auf der Erde zu verstehen“, sagt Univ.-Prof. Dr. Dirk Schneider vom Institut für Pharmazie und Biochemie der JGU, der die Forschungsarbeit koordiniert hat.
„Aber trotz ihrer großen Bedeutung wissen wir fast nichts darüber, wie dieses spezielle Membransystem gebildet und aufrechterhalten wird.“ Bislang wurde in photosynthetischen Zellen noch kein einziges Fusionsprotein identifiziert, obwohl klar war, dass diese Klasse von Proteinen an der Bildung der Thylakoidmembran beteiligt sein muss.
Vor diesem Hintergrund hat die Mainzer Forschergruppe das Protein IM30 aus einer Blaualge, die als „frei lebender Chloroplast“ beschrieben werden kann, isoliert und untersucht. IM30 – „IM“ steht für „interne Membran“ und „30“ bezeichnet die atomare Masse von 30 Kilodalton – wurde Mitte der 1990er-Jahre erstmals beschrieben und es wurde gezeigt, dass es an interne Membranen bindet.
Die kombinierte Expertise der Arbeitsgruppen um Univ.-Prof. Dr. Dirk Schneider, Univ.-Prof. Dr. Jürgen Markl vom Institut für Zoologie der JGU und Prof. Dr. Tobias Weidner vom Max-Planck-Institut für Polymerforschung hat nun gezeigt, dass IM30 in einer Ringstruktur spezifisch an Phospholipide der Membranen andockt.
„Diese Bindung verändert die Membranstruktur und führt unter bestimmten Bedingungen zur Membranfusion“, erklärt Schneider. Entfernt man IM30, kommt es hingegen zu einem signifikanten Rückgang von Thylakoidmembranen und letztendlich zu einem Verlust der Lebensfähigkeit der Zellen. Das Fusionsprotein IM30 stellt somit einen Ausgangspunkt für die weitere Erforschung des neuartigen Fusionsmechanismus in den grünen Zellbestandteilen von Pflanzen und von Blaualgen dar.
Die interdisziplinäre Forschungsarbeit wurde maßgeblich von Doktoranden des Max Planck Graduate Center (MPGC) ausgeführt. Das MPGC wurde im Juni 2009 gegründet, um gemeinsame Projekte und Promotionen zwischen der Johannes Gutenberg-Universität Mainz und den beiden in Mainz ansässigen Max-Planck-Instituten für Polymerforschung und für Chemie zu fördern.
Veröffentlichung:
Raoul Hennig et al.
IM30 triggers membrane fusion in cyanobacteria and chloroplasts
Nature Communications, 8. Mai 2015
DOI: 10.1038/ncomms8018
http://www.nature.com/ncomms/2015/150508/ncomms8018/full/ncomms8018.html
Weitere Informationen:
Univ.-Prof. Dr. Dirk Schneider
Institut für Pharmazie und Biochemie – Therapeutische Lebenswissenschaften
Johannes Gutenberg-Universität Mainz (JGU)
55099 Mainz
Tel. 06131 39-25833
Fax 06131 39-25348
E-Mail: dirk.schneider@uni-mainz.de
http://www.bio.chemie.uni-mainz.de/46.php
http://www.uni-mainz.de/presse/65253.php – Pressemitteilung ;
http://www.bio.chemie.uni-mainz.de/46.php – Univ.-Prof. Dr. Dirk Schneider ;
http://www.bio.uni-mainz.de/zoo/312_DEU_HTML.php – Univ.-Prof. Dr. Jürgen Markl ;
http://www.mpip-mainz.mpg.de/89016/Dr_Tobias_Weidner – Prof. Dr. Tobias Weidner ;
http://www.nature.com/ncomms/index.html – Nature Communications
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Ideen für die Zukunft
TU Berlin präsentiert sich vom 22. bis 26. April 2024 mit neun Projekten auf der Hannover Messe 2024. Die HANNOVER MESSE gilt als die Weltleitmesse der Industrie. Ihr diesjähriger Schwerpunkt…

Peptide auf interstellarem Eis
Dass einfache Peptide auf kosmischen Staubkörnern entstehen können, wurde vom Forschungsteam um Dr. Serge Krasnokutski vom Astrophysikalischen Labor des Max-Planck-Instituts für Astronomie an der Universität Jena bereits gezeigt. Bisher ging…

Wasserstoff-Produktion in der heimischen Garage
Forschungsteam der Frankfurt UAS entwickelt Prototyp für Privathaushalte: Förderzusage vom Land Hessen für 2. Projektphase. Wasserstoff als Energieträger der Zukunft ist nicht frei verfügbar, sondern muss aufwendig hergestellt werden. Das…





















