Immunschutz durch Selbstzerstörung
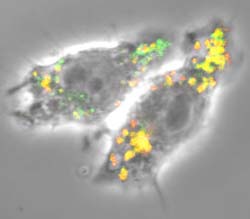
Abb. : Die Aufnahme durch das konfokale Mikroskop zeigt nicht infizierte dendritische Zellen, die Vesikel von Tuberkulose-infizierten Zellen (rot) in ihre zelleigenen Verdauungsbläschen (grün) aufgenommen haben. An den Stellen, wo die Vesikelinhalte zusammenkommen, entsteht eine Gelbfärbung. <br> <br>Foto: Max-Planck-Institut für Infektionsbiologie <br>
Mechanismus der T-Zellaktivierung bei Tuberkulose aufgeklärt / Entscheidender Fortschritt für die Entwicklung zukünftiger Impfstrategien
Bislang konnten sich die Wissenschaftler nicht erklären, warum die Impfung gegen Tuberkulose so wenig erfolgreich ist. Die in der Ausgabe August 2003 (Vol. 9, No. 8, Seite 1039) von Nature Medicine publizierten Ergebnisse der Arbeitsgruppe um Ulrich E. Schaible aus der Abteilung von Prof. Stefan H. E. Kaufmann vom Max-Planck-Institut für Infektionsbiologie in Berlin liefern nun entscheidende Einblicke in den Mechanismus der Aktivierung von T-Zellen im Zuge einer Infektion mit Mykobakterien, dem Erreger der Tuberkulose.
Ein Drittel der Weltbevölkerung ist nach Schätzungen der Weltgesundheitsorganisation (WHO) mit dem Erreger der Tuberkulose infiziert. Zum Glück erkranken davon nur zehn Prozent wirklich schwer, vor allem Menschen mit einem aufgrund von Hunger und Krankheit geschwächten Immunsystem. Mangelnde gesundheitliche Versorgung sowie unzureichende Ernährung haben allerdings in vielen osteuropäischen Staaten in den vergangenen Jahren dazu geführt, dass sich die Tuberkulose dort stark ausbreitet und sich multiresistente Stämme entwickeln konnten; diese stellen auch für das übrige Europa ein zunehmendes Gesundheitsrisiko dar. Eines der wichtigen Ziele der infektionsbiologischen Forschung ist daher die Entwicklung eines neuen Impfstoffes im Kampf gegen die Tuberkulose.
Dringen Bakterien in den Körper ein, so werden sie in der Regel von Makrophagen, den Fresszellen des Immunsystems, aufgenommen und zerkleinert. Die resultierenden Eiweißbruchstücke werden aufbereitet und im Verbund mit den so genannten MHC-Molekülen an der Oberfläche des Makrophagen präsentiert; sie werden so zum erkennbaren Antigen. Die Kopplung der Eiweißbruchstücke an das entsprechende MHC-Molekül (in diesem Fall die MHC-Moleküle Klasse I) erfolgt im Zytoplasma des Makrophagen. Anschließend werden die Eiweißbruchstücke zur Zelloberfläche transportiert, wo sie wie ein Fähnchen an den MHC-Molekülen flatternd den körpereigenen Abwehrzellen die Infektion signalisieren. Für den weiteren Verlauf der Immunabwehr sind dann die T-Lymphozyten (oder einfach T-Zellen) von entscheidender Bedeutung. Dabei unterscheiden die Forscher zwei verschiedene T-Zellpopulationen: jene, die so genannte CD4-Moleküle tragen und jene, an die CD8-Moleküle angeheftet sind. Diese Moleküle spielen im Erkennungsprozess eine wichtige Rolle, stabilisieren sie doch die Bindung zwischen MHC-Molekül und T-Zelle. CD8 T-Zellen können die mit dem Erreger der Tuberkulose, den Mykobakterien, infizierte Zellen abtöten.
Nun gelangen Mykobakterien jedoch gar nicht erst in das Zytoplasma der Fresszelle, wie die Forscher entdeckt haben. Eingeschlossen in ein flüssigkeitsgefülltes Bläschen, die Verdauungsvakuole des Makrophagen, hemmen sie dessen Reifung und schaffen sich auf diese Weise in ihrer Wirtszelle eine Nische zum Überleben und zur Vermehrung. Doch glücklicherweise besitzt unser Immunsystem einen zusätzlichen Schutzmechanismus, der den Zugriff auf die Erregerzellen sicherstellt, wie Schaible und seine Mitarbeiter am Berliner Max-Planck-Institut für Infektionsbiologie in Zusammenarbeit mit US-amerikanischen Kollegen jetzt zeigen konnten. „Der Makrophage startet ein Selbstzerstörungsprogramm – wir nennen das den programmierten Zelltod – und zerfällt dabei in kleine Stücke, so genannte Vesikel, die vollgepackt sind mit mykobakteriellen Antigenen“, erläutert der Infektionsbiologe. Diese Vesikel werden von nicht infizierten Nachbarzellen, in erster Linie den dendritischen Zellen, aufgenommen. Sie sind in der Lage, die Antigen-„Fähnchen“ an ihre MHC-Moleküle anzuheften, und lösen so auf eine sehr wirksame Weise die Immunantwort aus. Wird der programmierte Zelltod des Makrophagen im Experiment unterdrückt, werden auch keine T-Zellen aktiviert.
Mit ihren Untersuchungen konnten die Max-Planck-Wissenschaftler erstmals zeigen, dass eine solche Kreuzpräsentation, so der wissenschaftliche Fachbegriff, bei bakteriellen Infektionen des Menschen eine Rolle spielt ein Befund, der auch für eine zukünftige Impfstoffentwicklung von entscheidender Bedeutung sein könnte. Der bisher gebräuchliche BCG-Impfstoff löst tatsächlich keinen programmierten Zelltod aus und kann somit auch die CD8 T-Zellen nicht aktivieren; vielleicht ist er, so die Vermutung der Wissenschaftler, deshalb nicht richtig wirksam.
Originalveröffentlichung:
Schaible, U. E., Winau, F., Sieling, P.A., Fischer, K., Collins, H. L., Hagens, K., Modlin, R.L., Brinkmann, V., Kaufmann, S. H. E.
Apoptosis facilitates antigen presentation to T-Lymphocytes through MHC-I and CD1 in tuberculosis
Nature Medicine, Vol. 9, No. 8: 1039-1046, August 2003
Weitere Informationen erhalten Sie von:
Dr. Ulrich Schaible
Max-Planck-Institut für Infektionsbiologie, Berlin
Tel.: 030 28460 – 575
Fax.: 030 28460 – 501
E-Mail: schaible@mpiib-berlin.mpg.de
Media Contact
Alle Nachrichten aus der Kategorie: Medizin Gesundheit
Dieser Fachbereich fasst die Vielzahl der medizinischen Fachrichtungen aus dem Bereich der Humanmedizin zusammen.
Unter anderem finden Sie hier Berichte aus den Teilbereichen: Anästhesiologie, Anatomie, Chirurgie, Humangenetik, Hygiene und Umweltmedizin, Innere Medizin, Neurologie, Pharmakologie, Physiologie, Urologie oder Zahnmedizin.
Neueste Beiträge

Anlagenkonzepte für die Fertigung von Bipolarplatten, MEAs und Drucktanks
Grüner Wasserstoff zählt zu den Energieträgern der Zukunft. Um ihn in großen Mengen zu erzeugen, zu speichern und wieder in elektrische Energie zu wandeln, bedarf es effizienter und skalierbarer Fertigungsprozesse…

Ausfallsichere Dehnungssensoren ohne Stromverbrauch
Um die Sicherheit von Brücken, Kränen, Pipelines, Windrädern und vielem mehr zu überwachen, werden Dehnungssensoren benötigt. Eine grundlegend neue Technologie dafür haben Wissenschaftlerinnen und Wissenschaftler aus Bochum und Paderborn entwickelt….

Dauerlastfähige Wechselrichter
… ermöglichen deutliche Leistungssteigerung elektrischer Antriebe. Überhitzende Komponenten limitieren die Leistungsfähigkeit von Antriebssträngen bei Elektrofahrzeugen erheblich. Wechselrichtern fällt dabei eine große thermische Last zu, weshalb sie unter hohem Energieaufwand aktiv…





















