Das Zünglein an der Waage: Neue Denkanstöße für individuelle Krebstherapien
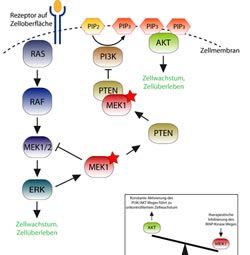
Schema der Interaktion von ERK und PI3K/AKT. Die Abschaltung des einen Signalweges führt zur Überaktivierung des anderen.<br>MFPL/Baccarini Lab<br>
Wenn die Balance zwischen diesen Signalen aus dem Gleichgewicht kommt, kann das zum unkontrollierten Zellwachstum und möglicherweise zur Krebsentstehung führen. Die Erkenntnisse, die aktuell im Fachjournal „Molecular Cell“ erscheinen, liefern neue Ansatzpunkte für „personalisierte Medizin“, bei der Krebspatienten eine individuell maßgeschneiderte Therapie erhalten.
Zellen müssen Umweltsignale wahrnehmen und darauf reagieren
Die Grundbausteine unseres Körpers, unsere Zellen, müssen eine Vielzahl von Signalen aus ihrer Umwelt wahrnehmen und verarbeiten. Die Wahrnehmung solcher Signale erfolgt über Rezeptoren an der Zelloberfläche, die wiederum spezifische Signaltransduktionswege in der Zelle auslösen. Diese Signalwege teilen den Zellen unter anderem mit, ob sie wachsen und sich vermehren sollen oder ob ein Angriff von Bakterien oder Viren abgewehrt werden muss. Im ERK-Signalweg, zum Beispiel, werden die Proteine RAS, RAF, MEK und ERK nacheinander aktiviert und regulieren dann die Embryonalentwicklung, die Differenzierung von Zellen, sowie das Zellwachstum und auch den programmierten Zelltod.
Signalwege für Zellwachstum werden durch MEK1 ausbalanciert
Von dem Protein MEK gibt es zwei Schwesterformen, MEK1 und MEK2. Vor einigen Jahren zeigte Baccarinis Team, dass MEK1 und MEK2 einen Komplex bilden, der nur inaktiviert werden kann, wenn beide Partner gemeinsam vorliegen. Wenn MEK1 zerstört wird, kann MEK2 nicht mehr abgeschaltet werden und der ERK-Signalweg bleibt kontinuierlich aktiv, was unkontrolliertes Zellwachstum auslösen kann. Um den MEK1/2 Komplex und somit den kompletten Signalweg abzuschalten, muss MEK1 durch aktives ERK an einer bestimmten Stelle markiert werden.
„Unsere neuen Ergebnisse haben nun gezeigt, dass diese Markierung von MEK1 auch notwendig ist, um einen weiteren Signalweg, den PI3K/AKT-Weg, der Zellwachstum und -überleben reguliert, auszuschalten“, sagt die Molekularbiologin Manuela Baccarini über die Studie, die im Rahmen des Doktoratskollegs „Molecular mechanisms of cell signaling“ durchgeführt wurde. Dafür muss MEK1 an das Protein PTEN binden und dieses zur Zellmembran führen, wo es die Produktion des Signalstoffes PIP3 stoppt. „MEK1 balanciert somit zwei Signalwege aus, die Wachstum und Überleben von Zellen bestimmen. Ist MEK1 zerstört, bleibt nicht nur der ERK-Signalweg angeschaltet, sondern auch der PI3K/AKT-Weg: Gemeinsam fördern diese Signalwege unkontrolliertes Zellwachstum“, erklärt Baccarini weiter.
Denkanstoß für „personalisierte Medizin“
Diese bedeutende Rolle von MEK1 erklärt auch, warum Krebsmedikamente, die den ERK-Signalweg blockieren, oft nach einiger Zeit nicht mehr wirksam sind. Baccarini erläutert: „Nun können wir besser verstehen, warum zum Beispiel Tumorzellen, die ERK-Inhibitoren bekommen, nach einer Weile eine Resistenz gegen diese Medikamente entwickeln und wieder wachsen. Da es kein markiertes MEK1 gibt, kann der PI3K/AKT Weg nicht abgeschaltet werden und fördert das Tumorwachstum.“
Diese Entdeckung stellt einen Ansatz für „personalisierte Medizin“ dar, bei der Patienten eine individualisierte Therapie erhalten. Denn in Patienten mit normal funktionierendem PTEN kann die Inhibierung des ERK-Signalweges zur Überaktivierung des PI3K/AKT-Weges führen. Diese müssten also gleichzeitig PI3K/AKT Inhibitoren erhalten. „Unsere Ergebnisse zeigen, dass man zelluläre Signalwege nicht in Isolation betrachten kann, sondern als das komplexe Netzwerk, das sie darstellen. Dessen Verlinkungen zu verstehen ist essentiell, um neue Medikamente zum Beispiel zur Krebsbehandlung zu entwickeln, aber auch um bestehende Therapien so zu optimieren, damit Patienten die effektivste Behandlung mit den wenigsten Nebenwirkungen erhalten“, sagt Baccarini abschließend.
Über die Max F. Perutz Laboratories
Die Max F. Perutz Laboratories (MFPL) sind ein gemeinsames Forschungs- und Ausbildungszentrum der Universität Wien und der Medizinischen Universität Wien am Campus Vienna Biocenter. An den MFPL sind rund 530 WissenschafterInnen in über 60 Forschungsgruppen mit Grundlagenforschung im Bereich der Molekularbiologie beschäftigt.
Publikation in „Molecular Cell“:
Katarina Zmajkovicova, Veronika Jesenberger, Federica Catalanotti, Christian Baumgartner, Gloria Reyes, and Manuela Baccarini: MEK1 is required for PTEN membrane recruitment, AKT regulation, and the maintenance of peripheral tolerance. In: Molecular Cell (2013).
DOI: http://dx.doi.org/10.1016/j.molcel.2013.01.037
Wissenschaftlicher Kontakt:
Ao. Univ.-Prof. Dr. Manuela Baccarini
Max F. Perutz Laboratories
Department für Mikrobiologie, Immunbiologie und Genetik
Universität Wien
1030 Wien, Dr.-Bohr-Gasse 9
T +43-1-4277-546 07
manuela.baccarini@univie.ac.at
Rückfragehinweis:
Dipl.-Ing. (FH) Georg Bauer
Max F. Perutz Laboratories
Communications
1030 Wien, Dr.-Bohr-Gasse 9
T +43-1-4277-240 03
georg.bauer@univie.ac.at
Media Contact
Weitere Informationen:
http://www.univie.ac.atAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Dauerlastfähige Wechselrichter
… ermöglichen deutliche Leistungssteigerung elektrischer Antriebe. Überhitzende Komponenten limitieren die Leistungsfähigkeit von Antriebssträngen bei Elektrofahrzeugen erheblich. Wechselrichtern fällt dabei eine große thermische Last zu, weshalb sie unter hohem Energieaufwand aktiv…

Kombination von Schwerionentherapie und mRNA-Impfstoff
Gemeinsam für die Krebsforschung: TRON und GSI/FAIR untersuchen Kombination von Schwerionentherapie und mRNA-Impfstoff. Es könnte eine neue, vielversprechende Kombination von zwei Therapieansätzen sein und ein Schlüssel, um Krebserkrankungen im fortgeschrittenen…

Im Gleichgewicht: Wie das Gehirn seine Sensitivität justiert
Eine sensitive Wahrnehmung unserer Umwelt ist essenziell, um unser Verhalten zu steuern. Reagieren die neuronalen Netzwerke im Gehirn jedoch zu empfindlich auf Reize, führt dies zu neurologischen Störungen wie Epilepsie….





















