Wie Rezeptoren für Medikamente im Zellinneren arbeiten
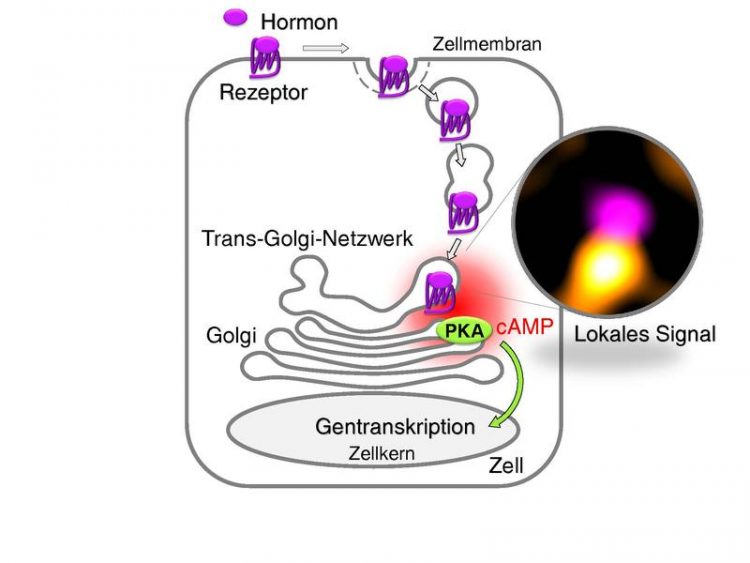
Nach der Bindung eines Hormons (TSH) wird der Rezeptor von der Zelle aufgenommen und zum TGN transportiert, wo er die lokale cAMP-Produktion steigert und die Proteinkinase A (PKA) aktiviert. Abbildung: AG Calebiro
G-Protein-gekoppelten Rezeptoren (GPCRs) werden zu Hunderten im menschlichen Erbgut kodiert. Sie bilden die größte Gruppe von Rezeptoren, über die Hormone und Neurotransmitter auf Zellen einwirken. Dementsprechend groß ist ihre Bedeutung als Angriffsstelle für therapeutisch wirksame Substanzen: Rund die Hälfte aller verschreibungspflichtigen Medikamente wirken auf diese Rezeptoren ein – und helfen so bei der Behandlung weitverbreiteter Krankheiten, wie etwa Bluthochdruck, Asthma oder Morbus Parkinson.
Publikation in Nature Communications
Lange Zeit war die Wissenschaft davon überzeugt, dass GPCRs auf der Zelloberfläche sitzen und nur von dort aus über verschiedene Signalketten Einfluss auf die Aktivität der Zelle nehmen. Diese Vorstellung ist in jüngster Zeit durch eine Reihe von Studien ins Wanken geraten. Diese Studien deuten darauf hin, dass GPCRs auch im Zellinneren aktiv sind.
Eine Bestätigung für diese Theorie haben jetzt Forscher um Professor Davide Calebiro vom Institut für Pharmakologie und Toxikologie und vom Bio-Imaging Center der Universität Würzburg geliefert. Die Ergebnisse ihrer Arbeit stellen sie in der aktuellen Ausgabe der Fachzeitschrift Nature Communications vor.
Vereinfacht dargestellt, sitzen G-Protein-gekoppelten Rezeptoren in der Zellwand und warten darauf, dass ein Hormon oder Neurotransmitter an sie bindet und sie dadurch aktiviert. Das Signal wird in die Zelle weitergeleitet, vor allem durch die Produktion eines intrazellulären Botenstoffes wie des zyklischen Adenosinmonophosphats (kurz cAMP). Dieser Botenstoff wiederum ist im Zellinneren an der Regulation einer Vielzahl von Zellfunktionen beteiligt, wie beispielsweise der Gentranskription und der Zellteilung.
Rezeptoren sind auch im Zellinneren aktiv
„Der erste Hinweis, dass GPCRs auch im Zellinneren die Produktion von cAMP anstoßen, stammte aus zwei Studien an typischen Protein-Hormon-Rezeptoren“, sagt Davide Calebiro. Für eine dieser Studien waren er und sein Team verantwortlich; sie hatten einen Rezeptor untersucht, der für die Produktion von Schilddrüsenhormonen wichtig ist – den sogenannten Thyreoidea-stimulierenden-Hormon(TSH)-Rezeptor.
„Die Studien zeigten unabhängig voneinander, dass GPCRs dazu in der Lage sind, im Zellinneren eine zweite Phase der cAMP-Produktion dauerhaft in Gang zu setzen“, so Calebiro. Tatsächlich sei ihre Wirkung dort „biologisch relevant“. Der genaue Mechanismus sei allerdings weitestgehend unklar gewesen.
Mit ihrer neuesten Studie ist es den Forschern der Universität Würzburg gemeinsam mit Kollegen der University of Birmingham gelungen, Details der Vorgänge im Zellinneren zu entschlüsseln. Als wichtigsten Hauptakteur identifizierten sie dabei das trans-Golgi-Netzwerk (TGN) – ein mit dem Golgi-Apparat verbundenes Netzwerk von Kanälen und Zisternen.
In diesem Netzwerk verteilt die Zelle modifizierte Proteine auf unterschiedliche Transportvesikel, mit denen diese anschließend an ihren Bestimmungsorten gebracht werden. „Unsere neue Daten zeigen, dass das TGN eine zentrale Schaltstelle für die Aktivität von G-Protein-gekoppelten Rezeptoren ist“, sagt Davide Calebiro. Sie zeigen dort einen neuen Mechanismus auf, der die zellulären Effekte der GPCR-Signale im Zellinneren erklären kann, so der Wissenschaftler.
Die Abläufe im Zellinneren
An Zellen der Schilddrüse läuft dieser Mechanismus demnach so ab: Nach Bindung von TSH werden TSH-Rezeptoren ins Zellinnere aufgenommen und zum trans-Golgi-Netzwerk transportiert. Dort aktivieren die Rezeptoren die Produktion von cAMP und ein weiteres Enzym – die Proteinkinase A. Dies geschieht alles in direkter Nachbarschaft zum Zellkern, in dem die genetische Information der Zelle liegt, und nimmt somit Einfluss auf den Ableseprozess der DNA (Gentranskription).
„Diese Studie bedeutet einen signifikanten Fortschritt“, ist sich Davide Calebiro sicher, da sie ein neues Modell präsentiert, das zeigt, wie die G-Protein-gekoppelte Signalkette im Zellinneren abläuft. Diese neuen Ergebnisse könnten „zur Entwicklung neuer Medikamente für eine Vielzahl von menschlichen Krankheiten führen, die spezifisch auf die Aufnahme von Rezeptoren oder auf Ihre Funktion im TGN wirken“.
Die Studie wurde unterstützt von der Deutschen Forschungsgemeinschaft DFG (Grant CA 1014/1-1 und SFB/Transregio 166–Projekt C1, Davide Calebiro).
Internalized TSH receptors en route to the TGN induce local Gs-protein signaling and gene transcription. Amod Godbole, Sandra Lyga, Martin J. Lohse & Davide Calebiro. Nature Communications, DOI: 10.1038/s41467-017-00357-2
Kontakt
Prof. Dr.med. Dr. Davide Calebiro, T: +49 931 31-80067, davide.calebiro@toxi.uni-wuerzburg.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















