Wie Blutgefässe veröden: Zellen verschmelzen mit sich selbst
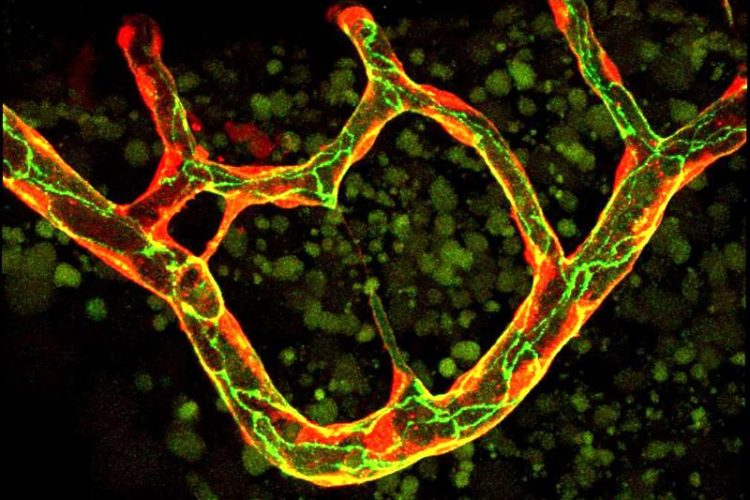
Blutgefässsystem des Zebrafisches in der Veränderungsphase. Einige der schmalen, dünnen Gefässe bilden sich zurück, um das Netzwerk zu optimieren. Biozentrum, Universität Basel
Blutgefäße bilden das Versorgungsnetzwerk des menschlichen Organismus. Sie versorgen ihn mit Sauerstoff und Nährstoffen bis in den letzten Winkel jedes Körperteils. Forschungsarbeiten über das Blutgefäßsystem konzentrierten sich bislang in erster Linie auf die Bildung eines solchen Netzwerkes.
Die Forschungsgruppe von Prof. Markus Affolter am Biozentrum der Universität Basel hat nun die Rückbildung nicht mehr benötigter Blutgefäße beim Zebrafisch genauer untersucht und entdeckt, dass die Zellen fähig sind, ihre Membranränder mit sich selbst verschmelzen zu lassen. Dass Gefässzellen von Wirbeltieren diese Eigenschaft haben, war bislang unbekannt.
«Self-Fusion» erstmals im Wirbeltier beobachtet
Die Bildung von Blutgefäßen folgt einem komplizierten Architekturplan. «Der Plan für die Rückbildung ist auf den ersten Blick gleich, muss auf molekularer Ebene jedoch unterschiedlich sein», sagt Markus Affolter. Bei der Verödung eines Blutgefäßes wandern die meisten Zellen in die benachbarten, funktionellen Gefässe. Die letzte Zelle, die im sich zurückbildenden Gefäss bleibt, fusioniert mit sich selbst und schliesst das Gefäss ab. Bei dem als «Self-Fusion» bezeichneten Prozess breitet sich eine Zelle um das gesamte Gefäss aus.
Die dabei aufeinandertreffenden Membranränder dieser Zelle verschmelzen mit sich selbst und verschliessen so die Öffnung. So wird sichergestellt, dass bei der Verödung eines Gefässes kein Loch zurückbleibt, aus dem Blut austreten kann. Es ist das erste Mal, dass das Verschmelzen von Zellen mit sich selbst bei Wirbeltieren, zu denen auch der Mensch zählt, beobachtet werden konnte. «Bisher kannte man ein solches Verhalten von Zellen nur bei einfacheren Organismen wie dem Fadenwurm», erklärt Markus Affolter.
Hohe Plastizität durch «Self-Fusion»
Während der Ausbildung des Blutgefäßnetzwerkes bilden sich immer wieder auch Gefässe, die nur vorrübergehend benötigt werden. Wie bei einem stillgelegten Flussarm eines weit verzweigten Gewässernetzes, durchfliesst diese Gefässe kein frisches Blut mehr und der Organismus beginnt mit dem Abbau dieses Seitenarms. Auf diese Weise reguliert sich das Blutgefäßsystem von allein, optimiert seinen Blutfluss, indem überschüssige Gefässe, in denen sich der Blutdurchfluss und damit der Blutdruck verringern, zurückgebildet und deren Zellen recycelt werden.
«Dieser neu gefundene Prozess ist für das zelluläre Verständnis vom Auf- und Abbau von Blutgefäßen wichtig, da sich damit einmal mehr die unglaublich grosse Plastizität und Wandelbarkeit des Blutgefäßsystems erklären lässt», so Anna Lenard, Erstautorin der Publikation. Die Studie wurde am Zebrafisch durchgeführt, da sich in dem fast durchsichtigen Fisch die Blutgefäßentwicklung mittels moderner Mikroskopiertechniken am lebenden Tier beobachten lässt.
Bedeutung von «Self-Fusion» bei Krebs
«Wie die Zelle beim aufeinandertreffenden der Membranränder sich selbst erkennt, und dabei nur mit sich und nicht mit anderen, benachbarten Blutgefäßzellen fusioniert, weiss man bislang jedoch noch nicht», so Markus Affolter. Schon lange liegt der Verdacht nahe, dass jede einzelne Zelle eines Organismus einen eigenen Code hat.
«Dieser Prozess könnte diese Theorie teilweise bestätigen», meint Affolter. Mit seinem Team möchte er nun untersuchen, was beim «Self-Fusion»-Prozess in der Zelle genau passiert. Da Tumore für ihr Wachstum ein gut ausgebildetes Blutgefäßsytem benötigen, könnte ein besseres Verständnis über die Bildung und Rückbildung des Netzwerkes Möglichkeiten eröffnen, wie sich ein solches System manipulieren liesse.
Originalartikel:
Anna Lenard, Stephan Daetwyler, Charles Betz, Elin Ellertsdottir, Heinz-Georg Belting, Jan Huisken, Markus Affolter:
Endothelial Cell Self-fusion during Vascular Pruning.
PLoS Biology, published online 17 April 2015 | DOI: 10.1371/journal.pbio.1002126
Weiter Informationen:
Heike Sacher, Kommunikation Biozentrum, Universität Base, Tel. +41 61 267 14 49, E-Mail: heike.sacher@unibas.ch
https://www.unibas.ch/de/Aktuell/News/Uni-Research/Wie-Blutgef-sse-ver-den.html
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Nanofasern befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…





















