Wichtiges Molekül für Botenstoffausschüttung in Synapsen identifiziert

Neurotransmission: Proteine generieren und platzieren „release sites“ für effiziente Übertragung Vollständige BU siehe Text Mathias Böhme, Andreas Grasskamp, Alexander Walter, FMP
Damit Nervenzellen miteinander kommunizieren können, werden an ihren Kontaktstellen, den Synapsen, chemische Botenstoffe freigesetzt. Dies geschieht durch synaptische Vesikel (Bläschen), die dabei mit der Zellmembran verschmelzen. Dieser Vorgang findet nicht irgendwo statt, sondern an ganz bestimmten Stellen innerhalb der Synapse.
Wissenschaftler vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie und der Freien Universität Berlin haben nun das Molekül identifiziert, das diese Freisetzungsorte definiert und damit ein großes Rätsel in den Neurowissenschaften gelöst. Jetzt ist die wegweisende Arbeit im renommierten Fachmagazin „Neuron“ erschienen.
Damit Nervenzellen miteinander kommunizieren können, werden an ihren Kontaktstellen, den Synapsen, chemische Botenstoffe freigesetzt. Dies geschieht durch synaptische Vesikel (Bläschen), die dabei mit der Zellmembran verschmelzen. Dieser Vorgang findet nicht irgendwo statt, sondern an ganz bestimmten Stellen innerhalb der Synapse.
Wissenschaftler vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) und der Freien Universität Berlin (FU) haben nun das Molekül identifiziert, das diese Freisetzungsorte definiert und damit ein großes Rätsel in den Neurowissenschaften gelöst. Die Ergebnisse tragen zu einem besseren Verständnis der synaptischen Transmission bei, sind aber auch Grundlage, um pathologische Vorgänge im Nervensystem besser erklären zu können. Jetzt ist die wegweisende Arbeit im renommierten Fachmagazin „Neuron“ erschienen.
Ob wir sprechen, laufen oder denken – unser Nervensystem ist ständig gefordert, elektrische Signale in chemische Informationen um- und wieder zurückzuwandeln. Diese Umwandlung passiert an den Kontaktstellen der Nervenzellen, den Synapsen.
Erreicht ein elektrisches Signal die Synapse, wird ein Kalziumeinstrom durch spannungsabhängige Kalziumkanäle ausgelöst, der wiederum dazu führt, dass synaptische Vesikel die in ihnen gespeicherten chemischen Botenstoffe (Neurotransmitter) innerhalb weniger Millisekunden freisetzen. Hierzu verschmelzen die Vesikel blitzschnell mit der Zellmembran.
Die chemischen Botenstoffe werden dann von der benachbarten Nervenzelle wiederum in ein elektrisches Signal zurückgewandelt. Wissenschaftler nennen das „synaptische Transmission“ – ein Vorgang, der elementar für Lebewesen ist.
Bekannt ist, dass jede Synapse über eine Vielzahl solcher Vesikel verfügt; die Botenstoffausschüttung jedoch nur an wenigen, ganz bestimmten Stellen erfolgt. Ähnlich wie bei den Startblöcken auf einer Aschenbahn, scheint die räumliche Anordnung der Freisetzungsorte zum Kalziumkanal elementar für die synaptische Transmission zu sein: Hier wie dort entscheidet der richtige Abstand darüber, wie schnell das Ziel erreicht werden kann – in diesem Fall, wie schnell das elektrische Signal in chemische Information umgewandelt wird. Bislang war allerdings unklar, welches Molekül diese Freisetzungsorte (engl. ‚release sites‘) festlegt.
Raum und Zeit sind aneinander gekoppelt
Wissenschaftler vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) und der Freien Universität Berlin (FU) konnten das fragliche Molekül nun identifizieren: Es handelt sich um das Protein Unc13A, das seinerseits kein Unbekannter ist. Schon in 1970er Jahren wurde es entdeckt, da Fehlfunktionen dieses Proteins bei Fadenwürmen zu unkoordinierten (engl. „uncoordinated“) Bewegungen führten, was die Namensgebung erklärt und schon damals auf eine wichtige Funktion des Moleküls schließen ließ.
„Wir wussten, dass das Molekül eine wichtige Rolle beim Informationstransfer spielt, denn wenn es fehlt, findet keinerlei synaptische Transmission mehr statt“, erläutert Neurowissenschaftler Dr. Alexander Walter vom FMP. „Wir wussten aber nicht, dass es auch den Platz für die Freisetzung der Botenstoffe aus Vesikeln definiert.“
Rund vier Jahre haben die Forscher gebraucht, um das Molekül durch die Kombination verschiedenster Messungen und optischer Methoden dingfest zu machen. Wurde das Protein innerhalb der Synapse anders platziert, verschoben sich auch die Freisetzungsorte und somit ihr Abstand zum Kalziumkanal. Dadurch änderte sich auch der zeitliche Verlauf der synaptischen Transmission, ähnlich dem Verschieben von Startblöcken zur Ziellinie.
Je nach Abstand dauerte der Informationstransfer kürzer oder länger. Damit bewahrheitete sich die Vermutung, dass die räumliche Anordnung der Freisetzungsorte fest an den zeitlichen Ablauf des Informationstransfers zwischen Nervenzellen gekoppelt ist. „In unserer Studie konnten wir zeigen, dass die exakte Positionierung nötig ist, damit die synaptische Transmission mit einer bestimmten Geschwindigkeit erfolgen kann“, betont Walter. „Ich denke, jeder kann sich vorstellen, wie wichtig dies für eine akkurate Kommunikation zwischen den Nervenzellen und somit für die Funktionsweise des Gehirns ist.“
Bedeutung über die Grundlagenforschung hinaus
Der Fund hat wesentlich zum Verständnis beigetragen, wie die synaptische Transmission organisiert ist und eine große Lücke in den Neurowissenschaften geschlossen.
Die Untersuchungen wurden an der Fruchtfliege durchgeführt, jedoch lässt sich das Prinzip der definierten Freisetzungsorte durch das essentielle Vorhandensein von Unc13 Proteinen auf höhere Organsimen bis zum Menschen mit hoher Wahrscheinlichkeit speziesübergreifend übertragen.
„Erst wenn wir die Grundlagen synaptischer Transmission kennen, sind wir in der Lage, auch pathologische Veränderungen zu verstehen, ähnlich der Tatsache, dass man ein Auto erst reparieren kann, wenn man dessen Funktionsweise verstanden hat“, meint Neurowissenschaftler Walter. Darum habe die Identifizierung des Moleküls auch Bedeutung über die Grundlagenforschung hinaus und könnte eines Tages Patienten mit neurologischen Erkrankungen zu Gute kommen.
Quelle:
Reddy-Alla, S., Böhme, M. A., Reynolds, E., Beis, C., Grasskamp, A. T., Mampell, M.M., Maglione, M., Rey, U., Babikir, H., McCarthy, A. W., Quentin, C., Matkovic, T., Dufour Bergeron, D., Mushtaq, Z., Göttfert, F., Owald, D., Mielke, T., Hell, S. W., Sigrist, S. J., and Walter, A. M.. (2017) Stable positioning of Unc13 restricts synaptic vesicle fusion to defined release sites to promote synchronous neurotransmission. Neuron http://dx.doi.org/10.1016/j.neuron.2017.08.016
Ansprechpartner für weitere Informationen:
Dr. Alexander M. Walter
Molecular and Theoretical Neuroscience
Leibniz Institute für Moleculare Pharmakologie
Charité Campus Mitte
Charitéplatz 1
10117 Berlin
Tel. +49 (0)30-450-639-026
E-Mail awalter@fmp-berlin.de
Öffentlichkeitsarbeit
Leibniz-Institut für Molekulare Pharmakologie (FMP)
Silke Oßwald
Tel. +49 (0)30-94793-104
E-Mail osswald@fmp-berlin.de
Das Leibniz-Institut für Molekulare Pharmakologie (FMP) gehört zum Forschungsverbund Berlin e.V. (FVB), einem Zusammenschluss von acht natur-, lebens- und umweltwissenschaftlichen Instituten in Berlin. In ihnen arbeiten mehr als 1.900 Mitarbeiter. Die vielfach ausgezeichneten Einrichtungen sind Mitglieder der Leibniz-Gemeinschaft. Entstanden ist der Forschungsverbund 1992 in einer einzigartigen historischen Situation aus der ehemaligen Akademie der Wissenschaften der DDR.
Bildunterschrift:
Neurotransmission: Proteine generieren und platzieren „release sites“ für effiziente Übertragung
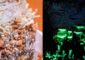
Illustration synaptischer Aktivität und Struktur in unterschiedlichen Größenordnungen beginnend mit der Aktivitätskarte (links) einer neuromuskulären Endplatte der Larve einer Taufliege (Drosophila melanogaster), an welcher neuronale Aktivität der Fliege in die Kontraktion des Muskels umgewandelt wird. Schwarze Punkte kennzeichnen einzelne Kontakte (Synapsen) zwischen Nerv und Muskel. Die Aktivität einzelner Synapsen wurde bestimmt und je nach Stärke von blau (= inaktiv) bis rot (= sehr aktiv) dargestellt. Durch ein hochauflösendes (STED-) Mikroskop konnte die Zusammensetzung der Orte synaptischer Aktivität (sogenannte „Aktive Zonen“) genauer gezeigt werden: Hier lokalisieren die Proteine Bruchpilot (BRP, grün) und Unc13A (magenta). Ein Schema skizziert die Funktion der Proteine genauer: Unc13A generiert „release sites“ an denen synaptische Vesikel – die Botenstoffe (Neurotransmitter) enthalten – freigesetzt werden. Diese Unc13A-„release sites“ (also ‚Freisetzungsorte‘) werden durch BRP an der Synapse genauestens positioniert um eine präzise regulierte Signalübertragung zu garantieren.
Illustration: Mathias Böhme, Andreas Grasskamp, Alexander Walter, FMP.
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…