Warum genau diese 20? – Quantenchemie löst Aminosäure-Rätsel
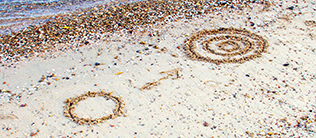
Die ersten 13 Aminosäuren sind durch sehr ähnliche chemische Härten und elektronische Energieniveaus (im Bild dargestellt als einzelner Kreis) gekennzeichnet. Die neuen Aminosäuren wurden im Laufe der Evolution dann zunehmend weicher und unterschiedlicher, was sich in aufspaltenden Energieniveaus widerspiegelt (im Bild dargestellt als mehrere konzentrische Kreise). Bildquelle: Michael Plenikowski
Mainzer Wissenschaftler um Dr. Matthias Granold und Univ.-Prof. Dr. Bernd Moosmann vom Institut für Pathobiochemie haben mittels quantenchemischer Berechnungen eine Lösung für eine der ältesten Fragen der Biochemie gefunden: Erstmals können sie erklären, warum es heute 20 Aminosäuren gibt, aus denen alles Leben aufgebaut ist, obwohl die ersten im Lauf der Zeit entstandenen 13 Aminosäuren ausreichen, um ein umfassendes Repertoire an funktionalen Proteinen aufzubauen.
Entscheidend, so die Forscher, ist die größere chemische Reaktivität der neueren Aminosäuren – weniger deren räumliche Struktur. In der renommierten Fachzeitschrift PNAS leiten sie darüber hinaus ab, dass der aufkommende Sauerstoff in der Atmosphäre diese Aufnahme weiterer Aminosäuren in den „Protein-Baukasten“ getriggert hat.
Alles Leben ist aus 20 Aminosäuren aufgebaut. Diese wiederum werden aus der Erbsubstanz DNA „abgelesen“: Dabei stehen jeweils drei aufeinanderfolgende DNA-Bausteine für eine Aminosäure – Forscher nennen dieses Raster den „genetischen Code“.
„Es war über Jahrzehnte rätselhaft, nach welchen Kriterien die 20 genetisch kodierten Aminosäuren von der Evolution ausgesucht worden sind“, beschreibt Univ.-Prof. Dr. Bernd Moosmann. „Besonders die letzten sieben Aminosäuren sind schwer erklärbar, da sich gute und funktionelle Proteine auch schon mit den ersten 10 bis 13 Aminosäuren zusammenbauen lassen.“
Die Forscher haben nun erstmals die Quantenchemie aller Aminosäuren, die das Leben benutzt, mit der Quantenchemie von Aminosäuren aus dem Weltall – gefunden in Meteoriten –sowie mit modernen Referenz-Biomolekülen verglichen. Dabei kam heraus, dass die neuen Aminosäuren systematisch „weicher“ (engl. „softer“) geworden sind. Chemisch „weich“ bedeutet dabei letztlich „leicht reaktiv“ oder chemisch leicht veränderbar.
„Man könnte sagen, dass der Übergang von der toten Chemie des Weltalls zur modernen Biochemie in einer stetig steigenden Weichheit und damit Reaktivität der Bausteine bestand“, so Professor Moosmann. Für die Entwicklung der letzten Aminosäuren spielten also funktionelle Aspekte die entscheidende Rolle. Echte strukturelle Innovationen bieten die neuesten Bausteine hingegen kaum. In biochemischen Experimenten konnten die Forscher das Ergebnis ihrer theoretischen Rechnungen verifizieren.
Die sich anschließende Frage lautet: Warum kamen die „weichen“ Aminosäuren hinzu? Womit sollten die neuen, leicht reaktiven Aminosäuren denn reagieren? Aus ihren Ergebnissen folgern die Wissenschaftler, dass zumindest einige dieser neuen Aminosäuren, speziell Methionin, Tryptophan und Selenocystein, als Folge des aufkommenden Sauerstoffs in der Atmosphäre hinzugefügt wurden. Dieser Sauerstoff fördert die Bildung toxischer freier Radikale – in der Konsequenz sind moderne Organismen und Zellen massiv „Oxidativem Stress“ ausgesetzt.
Die freien Radikale werden von den neueren Aminosäuren in sehr effizienter Weise gleichsam abgefangen – indem diese Aminosäuren chemische Reaktionen mit den freien Radikalen eingehen, die leicht reparierbar sind, und dadurch andere, wertvollere biologische Strukturen, die nicht reparierbar sind, vor der sauerstoff-induzierten Zerstörung schützen. Durch die neuen Aminosäuren ergab sich für die Urahnen aller heutigen Zellen somit ein echter Überlebensvorteil, der sie in der „neuen Welt“ bestehen ließ. „Man könnte den Sauerstoff daher auch als letzten Bildhauer des genetischen Codes verstehen“, veranschaulicht Professor Moosmann.
Originalpublikation:
Matthias Granold, Parvana Hajieva, Monica Ioana Tosa, Florin-Dan Irimie, Bernd Moosmann, Modern diversification of the amino acid repertoire driven by oxygen, PNAS, January 2, 2018, vol. 115, no. 1, 41–46
Doi: www.pnas.org/cgi/doi/10.1073/pnas.1717100115
Bildunterschrift:
Die ersten 13 Aminosäuren sind durch sehr ähnliche chemische Härten und elektronische Energieniveaus (im Bild dargestellt als einzelner Kreis) gekennzeichnet. Die neuen Aminosäuren wurden im Laufe der Evolution dann zunehmend weicher und unterschiedlicher, was sich in aufspaltenden Energieniveaus widerspiegelt (im Bild dargestellt als mehrere konzentrische Kreise).
Bildquelle: Michael Plenikowski
Kontakt
Univ.-Prof. Dr. Bernd Moosmann,
Institut für Pathobiochemie, Universitätsmedizin Mainz,
Telefon 06131 39-26707 oder -20186, Fax 06131 39-20185,
E-Mail: moosmann@uni-mainz.de
Pressekontakt
Dr. Renée Dillinger-Reiter,
Stabsstelle Unternehmenskommunikation, Universitätsmedizin Mainz,
Telefon 06131 17-7428, Fax 06131 17-3496,
E-Mail: pr@unimedizin-mainz.de
Über die Universitätsmedizin der Johannes Gutenberg-Universität Mainz
Die Universitätsmedizin der Johannes Gutenberg-Universität Mainz ist die einzige medizinische Einrichtung der Supramaximalversorgung in Rheinland-Pfalz und ein international anerkannter Wissenschaftsstandort. Sie umfasst mehr als 60 Kliniken, Institute und Abteilungen, die fächerübergreifend zusammenarbeiten. Hochspezialisierte Patientenversorgung, Forschung und Lehre bilden in der Universitätsmedizin Mainz eine untrennbare Einheit. Rund 3.300 Studierende der Medizin und Zahnmedizin werden in Mainz ausgebildet. Mit rund 7.800 Mitarbeiterinnen und Mitarbeitern ist die Universitätsmedizin zudem einer der größten Arbeitgeber der Region und ein wichtiger Wachstums- und Innovationsmotor.
Weitere Informationen im Internet unter www.unimedizin-mainz.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue Lösungsansätze für wachsende Resistenzen gegen Pilzmedikamente
Resistenzen gegen Pilzmedikamente (sog. Antimykotika) stellen Gesundheitssysteme weltweit vor große Herausforderungen. Auch in Österreich erkranken jährlich etwa 130.000 Menschen an Pilzinfektionen, die oftmals auch tödlich enden können. Mit dem neuen…

Standardisierte Wasserkühlung ebnet Weg für AI
Rittal auf dem 2024 OCP Regional Summit Lissabon Künstliche Intelligenz (AI) verändert die Welt der IT-Infrastruktur. Der Bedarf an Rechenleistung und Kapazität wächst so stark, dass auch die Anforderungen an…

Klimakrise gefährdet alpine Ökosysteme
Gebirge sind vom Klimawandel besonders betroffen: Sie erwärmen sich schneller als das Flachland. Mit der Erwärmung schwindet die Schneedecke und Zwergsträucher dringen in höhere Lagen vor – mit starken Auswirkungen…





















