Wandzellen der Blutgefäße steuern Metastasierung
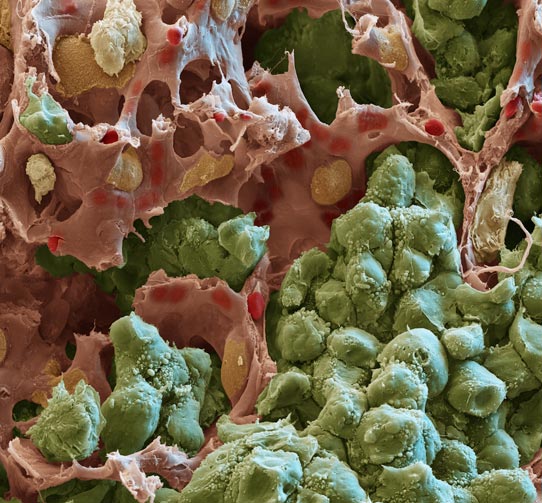
Legende: Rasterelektronenmikroskopische Aufnahme einer Lungenmetastase: Tumorzellen (grün) formen solide Tumorknoten, die in engem Kontakt mit umgebenden Kapillaren (rot) stehen. Die wechselseitige Kommunikation zwischen Tumorzellen und Endothelzellen ermöglicht das Wachstum von Metastasen. Endothelzellen können das Tumorwachstum dabei aktiv fördern. Quelle: Oliver Meckes (Eye of Science) / H. Augustin (DKFZ)
Die Kombinationstherapie wirkt gleich mehrfach gegen eine Ansiedlung von Tochtergeschwülsten: Sie verhindert, dass Blutgefäße die neu entstehenden Metastasen versorgen. Gleichzeitig reduziert sie die Anzahl bestimmter Immunzellen, die die Ansiedlung von Krebszellen fördern.
Bei vielen Krebserkrankungen gilt der Patient nach chirurgischer Entfernung des Tumors als krebsfrei. Doch bei einem großen Prozentsatz der Kranken hat der Tumor zu diesem Zeitpunkt bereits Zellen ausgestreut. Daher verordnen Ärzte im Anschluss an die Operation oft eine Chemotherapie, die abgesiedelte Krebszellen bekämpfen soll. Doch da es keine Methode gibt, diese gefährlichen Zellen direkt nachzuweisen, wissen Ärzte nicht, welcher Patient tatsächlich von der belastenden Therapie profitiert.
„Das ist ein großes Dilemma für viele Krebspatienten: Sollen sie sich für eine hochdosierte Chemotherapie mit allen schweren Nebenwirkungen entscheiden oder stattdessen ein höheres Risiko für Metastasen in Kauf nehmen?“, fragt Professor Hellmut Augustin. Seine Arbeitsgruppe am Deutschen Krebsforschungszentrum und der Medizinischen Fakultät Mannheim der Universität Heidelberg sucht daher nach schonenderen Alternativen, um die Entstehung von Tochtergeschwülsten zu unterdrücken.
Dabei setzen die Forscher auf neue wissenschaftliche Erkenntnisse, die eine weitaus aktivere Rolle der Wandzellen der Blutgefäße (Endothelzellen) für das Tumorwachstum nahelegen, als dies bisher bekannt war. Tumorzellen veranlassen Blutgefäße in ihrer Umgebung dazu, neue Kapillaren sprossen zu lassen, die den Tumor versorgen und sein Wachstum ermöglichen. Dieser „Angiogenese“ genannte Prozess wird bereits seit zehn Jahren therapeutisch genutzt; Angiogenese-hemmende Medikamente sollen die Wirkung etablierter Chemotherapeutika unterstützen.
Neuere Erkenntnisse zur Metastasierung weisen darauf hin, dass Endothelzellen darüber hinaus selbst zahlreiche Faktoren produzieren, die das Tumorwachstum fördern. Augustins Ansatz ist es daher, nicht nur die Gefäßbildung in Tumoren zu unterdrücken, sondern gleichzeitig die Produktion dieser Wachstumsfaktoren zu hemmen. In ihrer aktuellen Arbeit haben die Wissenschaftler das Molekül Angiopoietin-2 ins Visier genommen. Es wird von Endothelzellen gebildet und spielt eine zentrale Rolle bei der Angiogenese.
Die Forscher übertrugen Brust- oder Lungenkrebszellen auf Mäuse, ließen Tumoren heranwachsen und entfernten sie zu einem frühen Zeitpunkt operativ. Um Metastasen vorzubeugen, erhielten die Tiere nach der Operation verschiedene Arten der Chemotherapie sowie teilweise zusätzlich einen blockierenden Antikörper gegen Angiopoietin-2. Während die Chemotherapie allein nicht wirksam war, entwickelten mit dem Angiopoietin-2-Antikörper behandelten Tiere deutlich weniger Metastasen in Lunge und Knochen als ihre unbehandelten Artgenossen.
Gesteigert wurde dieser Effekt durch Kombination des Antikörpers mit einer so genannten metronomen Chemotherapie: Dabei werden die zytostatischen Substanzen niedrigdosiert dauerhaft verabreicht. Mäuse, die die Kombinationstherapie erhielten, lebten länger als Tiere, die nur mit dem Antikörper gegen Angiopoietin-2 behandelt wurden.
In anschließenden Gewebeanalysen untersuchten die Wissenschaftler, was die Kombinationstherapie genau bewirkt. Dabei entdeckten sie, dass Angiopoietin-2 nicht nur das Gefäßwachstum fördert, sondern darüber hinaus auf die Endothelzellen zurückwirkt und sie dazu anregt, tumorfördernde Makrophagen in die Umgebung der Krebszellen zu locken. Wurde Angiopoietin-2 blockiert, wanderten deutlich weniger krebsfördernde Immunzellen in die Tumorumgebung ein.
Die niedrigdosierte metronome Chemotherapie, die die Wirksamkeit des Therapieansatzes weiter steigerte, richtet sich im Gegensatz zur herkömmlichen Hochdosis-Chemotherapie nicht primär gegen die Tumorzellen selbst, sondern verhindert, dass sich bestimmte Zellen aus dem Knochenmark im Tumor ansiedeln, die ebenfalls das Tumorwachstum fördern.
„Mit unserer Kombinationstherapie gehen wir also von mehreren Seiten gleichzeitig gegen die Ansiedlung von Metastasen vor: Zum einen drosseln wir ihre Gefäßversorgung. Zum anderen verhindern wir, dass sich tumorfördernde Makrophagen ansiedeln, die eine entzündliche Umgebung schaffen und damit gewissermaßen den Boden für eine dauerhafte Ansiedlung der Krebszellen bereiten“, erklärt Hellmut Augustin.
„Wir können natürlich nicht voraussagen, ob sich die Ergebnisse dieser präklinischen Untersuchungen eins zu eins auf den Menschen übertragen lassen“, betont der Wissenschaftler. „Aber wir haben bei unseren Experimenten viel darüber gelernt, wie Metastasen entstehen. Das Wissen wollen wir nun gezielt in eine klinische Anwendung übersetzen.“
Kshitij Srivastava, Junhao Hu, Claudia Korn, Soniya Savant, Martin Teichert, Stephanie S. Kapel, Manfred Jugold, Eva Besemfelder, Markus Thomas, Manolis Pasparakis und Hellmut G. Augustin: Postsurgical adjuvant tumor therapy by combining anti-Angiopoietin-2 and metronomic chemotherapy limits metastatic growth. Cancer Cell 2014, DOI 10.1016/j.ccell.2014.11.005
Das Deutsche Krebsforschungszentrum (DKFZ) ist mit mehr als 3.000 Mitarbeiterinnen und Mitarbeitern die größte biomedizinische Forschungseinrichtung in Deutschland. Über 1000 Wissenschaftlerinnen und Wissenschaftler erforschen im DKFZ, wie Krebs entsteht, erfassen Krebsrisikofaktoren und suchen nach neuen Strategien, die verhindern, dass Menschen an Krebs erkranken. Sie entwickeln neue Methoden, mit denen Tumoren präziser diagnostiziert und Krebspatienten erfolgreicher behandelt werden können. Die Mitarbeiterinnen und Mitarbeiter des Krebsinformationsdienstes (KID) klären Betroffene, Angehörige und interessierte Bürger über die Volkskrankheit Krebs auf. Gemeinsam mit dem Universitätsklinikum Heidelberg hat das DKFZ das Nationale Centrum für Tumorerkrankungen (NCT) Heidelberg eingerichtet, in dem vielversprechende Ansätze aus der Krebsforschung in die Klinik übertragen werden. Im Deutschen Konsortium für Translationale Krebsforschung (DKTK), einem der sechs Deutschen Zentren für Gesundheitsforschung, unterhält das DKFZ Translationszentren an sieben universitären Partnerstandorten. Die Verbindung von exzellenter Hochschulmedizin mit der hochkarätigen Forschung eines Helmholtz-Zentrums ist ein wichtiger Beitrag, um die Chancen von Krebspatienten zu verbessern. Das DKFZ wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Baden-Württemberg finanziert und ist Mitglied in der Helmholtz-Gemeinschaft deutscher Forschungszentren.
Ansprechpartner für die Presse:
Dr. Stefanie Seltmann
Leiterin Presse- und Öffentlichkeitsarbeit
Deutsches Krebsforschungszentrum
Im Neuenheimer Feld 280
69120 Heidelberg
T: +49 6221 42-2854
F: +49 6221 42-2968
E-Mail: S.Seltmann@dkfz.de
Dr. Sibylle Kohlstädt
Presse- und Öffentlichkeitsarbeit
Deutsches Krebsforschungszentrum
Im Neuenheimer Feld 280
69120 Heidelberg
T: +49 6221 42 2843
F: +49 6221 42 2968
E-Mail: S.Kohlstaedt@dkfz.de
E-Mail: presse@dkfz.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Erstmals 6G-Mobilfunk in Alpen getestet
Forschende der Universität Stuttgart erzielen leistungsstärkste Verbindung. Notrufe selbst in entlegenen Gegenden absetzen und dabei hohe Datenmengen in Echtzeit übertragen? Das soll möglich werden mit der sechsten Mobilfunkgeneration – kurz…

Neues Sensornetzwerk registriert ungewöhnliches Schwarmbeben im Vogtland
Das soeben fertig installierte Überwachungsnetz aus seismischen Sensoren in Bohrlöchern zeichnete Tausende Erdbebensignale auf – ein einzigartiger Datensatz zur Erforschung der Ursache von Schwarmbeben. Seit dem 20. März registriert ein…

Bestandsmanagement optimieren
Crateflow ermöglicht präzise KI-basierte Nachfrageprognosen. Eine zentrale Herausforderung für Unternehmen liegt darin, Über- und Unterbestände zu kontrollieren und Lieferketten störungsresistent zu gestalten. Dabei helfen Nachfrage-Prognosen, die Faktoren wie Lagerbestände, Bestellmengen,…





















