Universeller Proteinadapter: Interaktionen von Membranproteinen mit Infrarotspektroskopie verfolgen
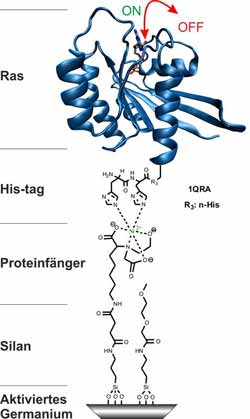
<br>An den Germaniumkristall (grau) hefteten die Bochumer Forscher Sauerstoffatome und erzeugten dadurch sogenanntes „aktiviertes Germanium“. Dieses diente als Andockstelle für Triethoxysilane, an die sich wiederum Proteine mit His-Tag binden lassen – zum Beispiel Ras. Das Schalterprotein Ras kann zwei Zustände – „An“ und „Aus“ – annehmen, die die Forscher mit der Infrarot-Differenz-Spektroskopie im Detail untersuchen konnten.<br><br>Grafik: modifiziert nach JACS<br>
Forscher der Ruhr-Universität Bochum haben eine neue Methode entwickelt, um Proteine an die Oberfläche von Germaniumkristallen zu heften – erstmals auch Membranproteine. Das erlaubt, Interaktionen zwischen Molekülen mittels Infrarotspektroskopie zeitaufgelöst bis auf einzelne Atome genau zu verfolgen.
Das Verfahren setzen sie im EU-Projekt „Kinetics for Drug Discovery, K4DD“ ein, in dem Wissenschaftler das Zusammenspiel von Arzneistoffen und ihren Interaktionspartnern ergründen. Mit der neuen Technik können sie nun auch sogenannte G-Protein-gekoppelte Rezeptoren untersuchen, die Wirkort für viele Medikamente sind. Das Team um Prof. Dr. Klaus Gerwert, PD Dr. Carsten Kötting und Jonas Schartner vom Lehrstuhl Biophysik berichtet im „Journal of the American Chemical Society“.
Proteine über Elektronenpaarbindungen an Germanium heften
Mit der Infrarot (IR)-Differenz-Spektroskopie analysieren Forscher dynamische Vorgänge in Proteinen. In einer früheren Studie war es Bochumer Biophysikern bereits gelungen, Proteine über Lipide an Germaniumoberflächen zu binden und sie so der IR-Spektroskopie zugänglich zu machen (wir berichteten im September 2012: http://aktuell.ruhr-uni-bochum.de/pm2012/pm00284.html.de). Dabei strahlen die Forscher in den Germaniumkristall Infrarotlicht ein, das vielfach an dessen Grenzflächen reflektiert wird. Ein Teil des Lichts tritt aus dem Kristall aus und erreicht so die auf der Oberfläche gebundenen Proteine. Früher nutzten die Forscher hydrophile Wechselwirkungen zwischen Kristall und Lipid – also Wechselwirkungen zwischen polaren Molekülgruppen – für die Bindung. Bei dem neuen Verfahren koppeln sie die Proteine über eine Elektronenpaarbindung an das Germanium. Diese ist stabiler und funktioniert sowohl für lösliche als auch für Membranproteine. „Membranproteine benötigen eine Art Seife als Außenhülle, ein Detergenz, welches eine Lipidschicht abwäscht. Unsere neu entwickelte Oberfläche bleibt im Gegensatz dazu stabil“, sagt Jonas Schartner.
Chemisches Baukastensystem
Wie bei einem Baukastensystem platzierten die Wissenschaftler verschiedene Molekülschichten übereinander auf dem Germaniumkristall. Zunächst erzeugten sie auf der Germaniumoberfläche Hydroxylgruppen, die jeweils ein Sauerstoff- und ein Wasserstoffatom besitzen. Das Produkt bezeichnet man als aktiviertes Germanium. Die nächste Schicht bildete eine neue Art von Triethoxysilanen, eine Kohlenwasserstoffverbindung, die das RUB-Team selbst herstellte. Ein Ende der Triethoxysilane verankerten die Forscher kovalent, also über eine Elektronenpaarbindung, am Germanium. Das andere Ende bauten sie zu einem Proteinfänger um. An diesen lassen sich alle Proteine knüpfen, die einen bestimmten Adapter, das His-Tag, tragen. „Es sind bereits viele Proteine mit diesem Universaladapter verfügbar“, sagt Carsten Kötting.
Kontrolliert die Germaniumoberfläche modifizieren
Mit Fourier-Transform-Infrarotspektroskopie und X-Ray-Photoelektronen-Spektroskopie (XPS) behielten die Forscher im Auge, was beim Stapeln der verschiedenen Schichten auf dem Germaniumkristall passierte. Gemeinsam mit Prof. Dr. Martin Muhler und Bastian Mei vom Lehrstuhl für Technische Chemie konnten die Biophysiker mit der XPS die atomare Zusammensetzung der Schichten genau bestimmen. Proteine können auch mit anderen Techniken, etwa der „Surface Plasmon Resonance“, auf Oberflächen beobachtet werden. „Dabei erfolgt die schrittweise Modifikation der Oberfläche blind“, erklärt Jonas Schartner. „Wir haben jeden Modifikationsschritt live beobachtet und so eine sehr gute Kontrolle über den Vorgang.“
Funktionstest für das neue Verfahren geglückt
Ein Test bestätigte, dass die neu gebastelte Oberfläche ihren Zweck erfüllt. Die Forscher bestückten den Germaniumkristall mit dem Schalterprotein Ras, das eine wichtige Rolle bei der Krebsentstehung spielt. Dort ließen sie es mit einem zweiten Molekül interagieren, das Ras an- und abschaltete. Diese beiden Zustände – „An“ und „Aus“ – spiegelten sich in den Infrarot-Differenzspektren wider. Mit der neuen Methode machte das RUB-Team also erfolgreich eine Proteininteraktion sichtbar. In Zukunft sollen Arzneistoffe und ihre Rezeptoren auf den Prüfstand. „Mit der herkömmlichen ‚Surface Plasmon Resonance‘-Methode kann nur festgestellt werden, ob eine Interaktion stattfindet. Eine Besonderheit unserer Methode ist, dass unterschiedliche Arten von Wirkstoffinteraktionen auch zu Unterschieden im Differenzspektrum führen“, so Jörn Güldenhaupt. „Durch diese Zusatzinformation kann der Wirkmechanismus viel besser untersucht werden. Das kann bei der Wirkstoffentwicklung entscheidend sein.“
Projektförderung
Fördermittel für das Projekt stammen vom Protein Research Department der RUB, vom Land NRW im Rahmen des „Centers for Vibrational Microscopy“ (CVM), der „Innovative Medicines Initiative“ (K4DD) und vom SFB 642 „GTP- und ATP-abhängige Membranprozesse“, dessen Sprecher Prof. Gerwert ist.
Titelaufnahme
J. Schartner, J. Güldenhaupt, B. Mei, M. Rögner, M. Muhler, K. Gerwert, C. Kötting (2013): Universal method for protein immobilization on chemically functionalized Germanium investigated by ATR-FTIR difference spectroscopy, Journal of the American Chemical Society, doi: 10.1021/ja400253p
Weitere Informationen
Jonas Schartner, Lehrstuhl Biophysik, Fakultät für Biologie und Biotechnologie der Ruhr-Universität, 44780 Bochum, Tel. 0234/32-24970, E-Mail: jonas.schartner@bph.rub.de
PD Dr. Carsten Kötting, Lehrstuhl Biophysik, Fakultät für Biologie und Biotechnologie der Ruhr-Universität, 44780 Bochum, Tel. 0234/32-24873, E-Mail: carsten.koetting@rub.de
Redaktion: Dr. Julia Weiler
Media Contact
Weitere Informationen:
http://www.ruhr-uni-bochum.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Merkmale des Untergrunds unter dem Thwaites-Gletscher enthüllt
Ein Forschungsteam hat felsige Berge und glattes Terrain unter dem Thwaites-Gletscher in der Westantarktis entdeckt – dem breiteste Gletscher der Erde, der halb so groß wie Deutschland und über 1000…

Wasserabweisende Fasern ohne PFAS
Endlich umweltfreundlich… Regenjacken, Badehosen oder Polsterstoffe: Textilien mit wasserabweisenden Eigenschaften benötigen eine chemische Imprägnierung. Fluor-haltige PFAS-Chemikalien sind zwar wirkungsvoll, schaden aber der Gesundheit und reichern sich in der Umwelt an….

Das massereichste stellare schwarze Loch unserer Galaxie entdeckt
Astronominnen und Astronomen haben das massereichste stellare schwarze Loch identifiziert, das bisher in der Milchstraßengalaxie entdeckt wurde. Entdeckt wurde das schwarze Loch in den Daten der Gaia-Mission der Europäischen Weltraumorganisation,…