„Unermüdliches Hören“ – eine molekulare Reinigungsmaschine regeneriert die Synapsen
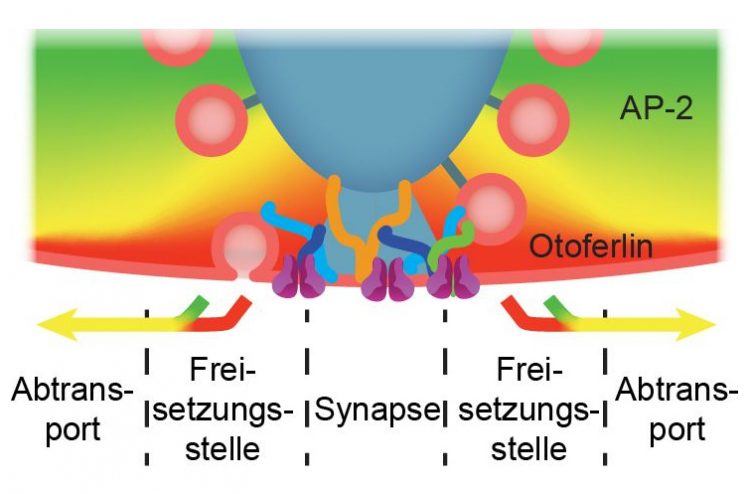
Abb. 1: „Reinigung“ der Freisetzungsstellen für synaptische Bläschen an der Bänder-Synapse. Nach dem Verschmelzen synaptischer Bläschen (rosa) mit der Zellmembran wird durch Interaktion von AP-2 (grün) mit Otoferlin (rot) ein schnellerer Abtransport von Eiweiß und Lipidmembran von der Freisetzungsstelle an der aktiven Zone ermöglicht. Quelle: Jung et al., EMBO J 2015
Etwa 360 Millionen Menschen – 5 Prozent der Weltbevölkerung – leiden nach Schätzung der Weltgesundheitsorganisation (WHO) an einer maßgeblichen Schwerhörigkeit. Noch ist wenig über die Funktion des Innenohrs bekannt, es gibt noch keinen ursächlichen Therapieansatz für die Innenohrschwerhörigkeit.
Göttinger und Berliner Wissenschaftler sind nun dem Verständnis von Hören wie der Behandlung der Schwerhörigkeit einen großen Schritt nähergekommen. Sie zeigen, dass die Interaktion zwischen einem für die Wiederverwertung von Eiweißen und Lipidmembranen verantwortlichen Adapterprotein und dem bei einigen Formen der Taubheit gestörten Freisetzungsfaktor Otoferlin einen Prozess beschleunigt, der kritisch für die unentwegte synaptische Übertragung von Hörinformation ist.
Fehlt der Adapter, kommt es an den Freisetzungsstellen offenbar zum „Stau“, die Übertragung wird verlangsamt und eine Schwerhörigkeit entsteht. Mittels viraler Genfähren gelang es den Forschern, das normale Hören im Mausmodell wiederherzustellen. Sie haben dadurch die Grundzüge für eine Gentherapie der Schwerhörigkeit im Tiermodell aufgezeigt.
Die Forschungserkenntnisse sind das Ergebnis einer Zusammenarbeit im Sonderforschungsbereich (SFB) 889 „Zelluläre Mechanismen der Sensorischen Verarbeitung“ von Arbeitsgruppen der Universitätsmedizin Göttingen (UMG) mit Gruppen der Universität Göttingen, der Max-Planck-Institute für Dynamik und Selbstorganisation und für Experimentelle Medizin in Göttingen sowie des Leibniz-Institut für Molekulare Pharmakologie in Berlin. Publiziert wurden die Forschungsergebnisse in der renommierten Fachzeitschrift EMBO Journal.
Originalveröffentlichung
Sangyong Jung#, Tanja Maritzen#, Carolin Wichmann#, Zhizi Jing, Andreas Neef§, Natalia H. Revelo, Hanan Al-Moyed, Sandra Meese, Sonja M. Wojcik, Iliana Panou, Haydar Bulut, Peter Schu, Ralf Ficner, Ellen Reisinger, Silvio O. Rizzoli, Jakob Neef, Nicola Strenzke, Volker Haucke§ and Tobias Moser§ (2015). Disruption of adaptor protein 2μ (AP-2μ) in cochlear hair cells impairs vesicle reloading of synaptic release sites and hearing. EMBO Journal, DOI: 10.15252/embj.201591885, online: Oct 7th, 2015
# gleichwertiger Beitrag zum Artikel
§ korrespondierender Autor
Die Umwandlung von akustischer Information in ein Nervensignal erfolgt an speziellen Kontaktstellen, den so genannten Bändersynapsen, zwischen Haarsinneszellen und Hörnervenzellen im Innenohr. Die beachtliche Übertragungsrate dieser Synapse liegt bei hunderten Signalen pro Sekunde.
Dies erfordert die hoch-koordinierte Bereitstellung, Fusion und „Entsorgung“ von Botenstoffbläschen an der aktiven Zone der Botenstofffreisetzung. Für diese bemerkenswerte Spitzenleistung wird das „Hörgen“ Otoferlin benötigt, aber die zugrundeliegenden Interaktionen von Otoferlin mit anderen Bestandteilen der Synapse sind noch nicht verstanden.
SCHNELLER NACHSCHUB ERFORDERT EFFIZIENTE ENTSORGUNG
Was begrenzt die Rate der Übertragung an der Haarzellsynapse und wie fördert Otoferlin die unermüdliche Botenstofffreisetzung? An jeder der nur etwa einen halben millionstel Meter großen aktiven Zonen können während der Stimulation vermutlich zirka 1.000 Bläschen pro Sekunde ihre Botenstoffe freisetzen. Das machen sie, indem sie mit der aktiven Zone verschmelzen.
Dieses hohe „Verkehrs-aufkommen“ bedingt, dass sehr viel Eiweiß und Lipidmembran aus den Bläschen in die Zellmembran der aktiven Zone gelangen. Die gestrandeten Eiweiß- und Lipidmoleküle müssen rasch abtransportiert werden, damit neue Bläschen an die Freisetzungsstellen der aktiven Zone andocken können (Abb. 1). Wie genau diese „Reinigung“ der Freisetzungsstellen geschieht, war bisher jedoch unklar.
Mit Hilfe genetisch veränderter Mäuse, denen das Adapter-Eiweiß AP-2µ fehlt, haben die Göttinger und Berliner Forscher nun herausgefunden, dass genau dieses Eiweiß bei der „Reinigung“ der Freisetzungsstellen eine wichtige Rolle spielt. Fehlt den Haarsinneszellen das Adapter-Eiweiß AP-2µ, sind die Tiere hochgradig schwerhörig (rote Kurve in Abb. 2).
Diese Schwerhörigkeit ergibt sich aus einem mangelnden Nachschub an freisetzungsbereiten Botenstoffbläschen wie mit mehreren experimentellen und mathematischen Methoden nachgewiesen wurde. Dr. Carolin Wichmann, Gruppenleiterin am Institut für Auditorische Neurowissenschaften an der UMG und eine der Erstautoren, sagt: „Überrascht waren wir davon, dass die Verminderung der Freisetzung bereits 20 tausendstel Sekunden nach Beginn der Stimulation sichtbar war. Bislang dachte man, dass AP-2 nur eine Rolle bei der deutlich langsameren Wiederherstellung von Botenstoffbläschen spielt.“
Um den zugrundeliegenden Mechanismus und die Rolle von AP-2 für die Funktion der Haarzellsynapse zu ergründen, untersuchten die Wissenschaftler die Interaktion von AP-2 mit synaptischen Proteinen und fanden eine Bindung an Otoferlin, dem selbst eine Rolle beim Nachschub von freisetzungsbereiten Botenstoffbläschen zugeschrieben wird. Dr. Tanja Maritzen, Gruppenleiterin am Leibniz-Institut für Molekulare Pharmakologie und eine der Erstautoren, sagt: „Wir fanden heraus, dass AP-2 und Otoferlin über mindestens zwei Kontaktstellen aneinander binden und dass AP-2 für die Verfügbarkeit von Otoferlin von großer Bedeutung ist.“
Aber wie kann die Interaktion dieser beiden Eiweiße den Nachschub von freisetzungsbereiten Botenstoffbläschen fördern? Dr. Andreas Neef, Gruppenleiter am Göttinger Bernstein Zentrum für Theoretische Neurowissenschaften und am Max-Planck-Institut (MPI) für Dynamik und Selbstorganisation, sagt als einer der korrespondierenden Autoren:
„Mit der Kombination systemphysiologischer Messungen der synaptischen Freisetzung an einzelnen aktiven Zonen und mathematischer Modellbildung konnten wir nahelegen, dass AP-2 durch seine Bindung an Otoferlin die „Reinigung“ der Freisetzungsstellen beschleunigt.“ Nach Ansicht der Wissenschaftler wird auf diese Weise das freigesetzte Material schneller von der aktiven Zone entfernt, so dass dort neue Botenstoffbläschen für die nächste Runde der Freisetzung andocken können (Abb. 1). Fehlt AP-2 oder Otoferlin, kommt es quasi zum „Stau“ und das Hören ist gestört.
Die Studie ist zudem eine der weltweit ersten, die im Tiermodell demonstriert, dass defekte Gene prinzipiell mit Hilfe unschädlicher Viren ersetzt werden können. Dr. SangYong Jung, wissenschaftlicher Mitarbeiter am Institut für Auditorische Neurowissenschaften an der UMG und Erstautor, sagt: „Wenn wir Viren, die die Erbinformation für AP-2µ enthielten, in die Hörschnecke der tauben Mäuse einbrachten, konnten wir die Funktion der Haarzellsynapsen und das Hören nahezu vollständig wiederherstellen.“
Die Leiter der Studie, Prof. Volker Haucke (Direktor des Leibniz-Instituts für Molekulare Pharmakologie und Professor an der Freien Universität Berlin) und Prof. Tobias Moser (Direktor des Instituts für Auditorische Neurowissenschaften der UMG und Max-Planck-Fellow an den MPIs für Biophysikalische Chemie und Experimentelle Medizin), sind sich einig, dass diese Studie ein wichtiger Durchbruch im Verständnis der Funktion von AP-2 und der synaptischen Übertragung ist und zugleich den Weg bahnt für die zukünftige Gentherapie am Menschen. Prof. Haucke:
„Das Hochleistungssystem der Haarzellsynapse hat uns ermöglicht, die Rolle von AP-2 an der aktiven Zone besser zu verstehen. AP-2 und Otoferlin arbeiten quasi als „Reinigungs-Team“, um die für das Hören erforderlichen spektakulären Übertragungsraten zu realisieren.“ Prof. Moser ergänzt: „Auch wenn bislang keine humane Schwerhörigkeit bekannt ist, die aus Defekten des AP-2 Gens resultiert, macht diese Studie Hoffnung, dass die viral-vermittelte Gentherapie in absehbarer Zeit möglich werden kann.
So sind das fast normale Hören des behandelten Ohres und das Ausbleiben einer Virus-Ausbreitung (etwa in das andere Ohr) starke Indizien dafür, dass eine frühzeitige Behandlung eine Auswahl genetischer Schwerhörigkeiten effizient bekämpfen kann. Die Studie zeigt auch, wie die interdisziplinäre Zusammenarbeit etwa im Göttinger Sonderforschungsbereich 889 „Zelluläre Mechanismen sensorischer Verarbeitung“ der Universitätsmedizin Göttingen (UMG) und darüber hinaus wichtige Durchbrüche erreichen kann“.
WEITERE INFORMATIONEN:
Dr. Carolin Wichmann, Dr. SangYong Jung, Prof. Dr. Tobias Moser
Institut für Auditorische Neurowissenschaften und InnenOhrLabor
Universitätsmedizin Göttingen, Georg-August-Universität
Dr. Carolin Wichmann
Arbeitsgruppe Molekulare Architektur von Synapsen
Telefon 0551 / 39-22604, carolin.wichmann@med.uni-goettingen.de
Dr. SangYong Jung, Prof. Dr. Tobias Moser
Institut für Auditorische Neurowissenschaften und InnenOhrLabor
Telefon 0551 / 39-22803, tmoser@gwdg.de
Dr. Tanja Maritzen, Prof. Dr. Volker Haucke
Leibniz-Institut für Molekulare Pharmakologie, Berlin
Telefon 030-94793101, HAUCKE@fmp-berlin.de
Media Contact
Weitere Informationen:
http://www.universitaetsmedizin-goettingen.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Das massereichste stellare schwarze Loch unserer Galaxie entdeckt
Astronominnen und Astronomen haben das massereichste stellare schwarze Loch identifiziert, das bisher in der Milchstraßengalaxie entdeckt wurde. Entdeckt wurde das schwarze Loch in den Daten der Gaia-Mission der Europäischen Weltraumorganisation,…

Neues Schweißverfahren für Windräder
… ermöglicht beschleunigte Produktion. Die Bundesanstalt für Materialforschung und -prüfung (BAM) stellt auf der diesjährigen Hannover Messe ein innovatives Schweißverfahren für Windräder vor, mit dem sich die Produktionsgeschwindigkeit von Windgiganten…

Wie Blaualgen Mikroorganismen manipulieren
Forschungsteam an der Universität Freiburg entdeckt ein bisher unbekanntes Gen, das indirekt die Photosynthese fördert. Cyanobakterien werden auch Blaualgen genannt und gelten als „Pflanzen des Ozeans“, weil sie in gigantischen…





















