Synthetische Biologie: TUM-Forscher entwickeln neuartiges Leuchtprotein
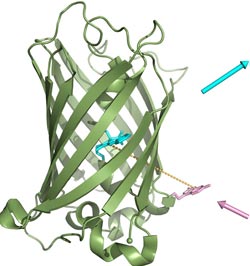
Wechselspiel zweier Farbstoffe in dem biosynthetischen Leuchtprotein<br>(Grafik: A. Skerra / TUM)<br>
Protein-Designer der Technischen Universität München (TUM) in Weihenstephan haben das bekannte Leuchtprotein jetzt weiterentwickelt: Sie haben es geschafft, eine künstliche Aminosäure in das natürliche Eiweiß einzubauen und so mittels synthetischer Biologie ein neuartiges fluoreszierendes Biomolekül herzustellen. Dieses Leuchtprotein schimmert dank Ausnutzung eines besonderen physikalischen Effekts türkis, wenn es mit ultraviolettem Licht angeregt wird, und weist bislang unerreichte Eigenschaften auf.
Proteine sind die wichtigsten biomolekularen Funktionsträger in der Natur mit zahlreichen Anwendungsmöglichkeiten in der biowissenschaftlichen Grundlagenforschung, Biotechnologie und Medizin. Wie modifiziert man solche Eiweißstoffe möglichst effizient, um gewünschte Eigenschaften zu erreichen? Bislang verändert man sie in der Regel entweder auf chemischem Weg oder mit gentechnologischen Methoden. Ein Team um Prof. Dr. Arne Skerra vom Lehrstuhl für Biologische Chemie der TUM hat nun eine elegantere kombinierte Lösung gefunden: Die Forscher können unter Erweiterung des ansonsten universell gültigen genetischen Codes Bakterienzellen dazu bringen, maßgeschneiderte Proteine mit künstlichen chemischen Bausteinen zu produzieren. Die Probe aufs Exempel machten sie mit einer besonders harten Nuss: Die Forscher wollten eine nicht-natürliche Aminosäure an einer ganz bestimmten Stelle in ein verbreitet eingesetztes natürliches Protein einbauen.
Dieses Eiweiß ist in der Bioforschung als „GFP“ (= grün fluoreszierendes Protein) wohlbekannt: Es leuchtet knallgrün und entstammt ursprünglich einer Meeresqualle, der es in dunklen Wassertiefen Sichtbarkeit verleiht. Als synthetischen Baustein wählte das Team einen hellviolett leuchtenden Cumarin-Farbstoff, der als Seitenkette einer künstlichen Aminosäure diente. Diese synthetische Aminosäure „fütterten“ die Forscher einer Laborkultur von Escherichia-coli-Bakterien – als Arbeitspferde der Gentechnik dienenden Mikroorganismen, deren natürliche Geschwister auch im menschlichen Darm zu finden sind. Da das Team den Bakterien auch den abgewandelten genetischen Bauplan für das GFP – einschließlich der benötigten Biosynthesemaschinerie – übertragen hatte, bauten diese die fluoreszenzaktive Aminosäure an einer genau definierten Stelle in das Leuchtprotein ein.
Dieser Ort im GFP war mit Bedacht gewählt, erläutert Prof. Skerra: „Wir haben die synthetische Aminosäure innerhalb des natürlichen Proteins in einer ganz bestimmten Entfernung von dem natürlicherweise darin vorkommenden Leuchtzentrum positioniert“. Die Forscher spekulierten dabei auf den so genannten Förster-Resonanzenergietransfer- oder kurz: FRET-Effekt. Dieser nach dem deutschen Physikochemiker Theodor Förster benannte Prozess der physikalischen Energieübertragung sorgt dafür, dass unter günstigen geometrischen Bedingungen strahlungsfrei Energie von einem angeregten Farbstoff zu einem anderen fließen kann.
Genau dieser FRET-Effekt konnte bei dem neu entwickelten Leuchtprotein in eleganter Weise realisiert werden. Die Forscher legten den Abstand zwischen dem eingeführten chemischen Farbstoff und dem biologischen Grünblau-(genauer: Cyan)-Farbstoff der Meeresqualle nämlich genau so, dass das Wechselspiel der beiden Pigmente in dem resultierenden Verbundmolekül zu einer ganz neuartigen Fluoreszenzaktivität führte: Wegen der extremen Nähe der beiden Leuchtstoffe ist das Hellviolett der künstlichen Aminosäure nicht mehr messbar, sondern es dominiert der typische grünblaue Farbton des Leuchtproteins. „Das Besondere ist, dass sich dank der eingebauten künstlichen Aminosäure sein Leuchten im Gegensatz zu dem natürlichen GFP schon mit einer handelsüblichen Schwarzlichtlampe auslösen lässt, anstatt einen teuren Speziallaser zu bemühen“, erklärt Sebastian Kuhn, der diese wegweisenden Experimente im Rahmen seiner Doktorarbeit realisiert hat.
Das Herstellungsprinzip des neuartigen Biomoleküls, das sich durch eine bislang schwer erreichbare, besonders große Differenz in der Wellenlänge zwischen anregendem und ausgesandtem Licht auszeichnet, dürfte zahlreiche interessante Anwendungen eröffnen, so Skerra: „Wir haben jetzt gezeigt, dass die Technik grundsätzlich funktioniert. Mit unserer Methode kann man in Zukunft Leuchtproteine in diversen Farben für vielfältige Anwendungen maßgeschneidert herstellen.“ Dieses Forschungsprojekt wurde aus Mitteln der Deutschen Forschungsgemeinschaft im Rahmen des Exzellenzclusters Munich Center for Integrated Protein Science (CIPS-M) unterstützt.
Publikation:
Sebastian M. Kuhn, Marina Rubini, Michael A. Müller und Arne Skerra (2011): Biosynthesis of a fluorescent protein with extreme pseudo-Stokes shift by introducing a genetically encoded non-natural amino acid outside the fluorophore. Journal of the American Chemical Society 133, 3708-3711. Online-Vorabveröffentlichung unter http://pubs.acs.org/doi/abs/10.1021/ja1099787. (DOI: 10.1021/ja1099787)
Kontakt:
Prof. Dr. Arne Skerra
Lehrstuhl für Biologische Chemie
Technische Universität München
Emil-Erlenmeyer-Forum 5
85350 Freising-Weihenstephan
Tel.: 08161 / 71-4350
E-Mail: skerra@tum.de
Media Contact
Weitere Informationen:
http://www.wzw.tum.de/bcAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Merkmale des Untergrunds unter dem Thwaites-Gletscher enthüllt
Ein Forschungsteam hat felsige Berge und glattes Terrain unter dem Thwaites-Gletscher in der Westantarktis entdeckt – dem breiteste Gletscher der Erde, der halb so groß wie Deutschland und über 1000…

Wasserabweisende Fasern ohne PFAS
Endlich umweltfreundlich… Regenjacken, Badehosen oder Polsterstoffe: Textilien mit wasserabweisenden Eigenschaften benötigen eine chemische Imprägnierung. Fluor-haltige PFAS-Chemikalien sind zwar wirkungsvoll, schaden aber der Gesundheit und reichern sich in der Umwelt an….

Das massereichste stellare schwarze Loch unserer Galaxie entdeckt
Astronominnen und Astronomen haben das massereichste stellare schwarze Loch identifiziert, das bisher in der Milchstraßengalaxie entdeckt wurde. Entdeckt wurde das schwarze Loch in den Daten der Gaia-Mission der Europäischen Weltraumorganisation,…





















