Synapsen recyceln Proteine für Freisetzung von Botenstoffen
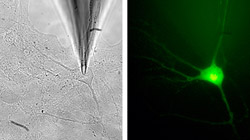
Mit einer winzigen Elektrodenspitze kann die elektrische Aktivität von Nervenzellen gemessen werden (oben). Der etwa 20 Tausendstel Millimeter große Zellkörper der Nervenzelle erscheint im Fluoreszenzmikroskop grün, weil er mit einem Kalzium-empfindlichen Farbstoff gefüllt ist (unten). Bild: Nils Brose<br>
Nervenzellen kommunizieren über chemische Botenstoffe, die sie in kleinen Bläschen, den synaptischen Vesikeln, speichern und bei Bedarf ausschütten. Um zuverlässig auf eine Nervenerregung reagieren zu können, müssen Nervenzellen eine bestimmte Menge 'akut freisetzbarer' Vesikel bereithalten.
Neurowissenschaftler des Max-Planck-Instituts für Experimentelle Medizin in Göttingen haben nun mit Hilfe einer neuen Methode herausgefunden, dass Nervenzellen die für die Botenstoff-Freisetzung nötigen Eiweiß-Bausteine systematisch wiederverwerten und so die Zuverlässigkeit der Signalübertragung im Gehirn gewährleisten.
Ist dieser Prozess gestört, kommt die Kommunikation zwischen Nervenzellen schnell zum Erliegen, und lebenswichtige Prozesse, die von einer schnellen Informationsvermittlung abhängen, wie etwa das Sehen oder die schnelle Ortung einer Schallquelle, werden unmöglich. (Neuron, 4. November 2010)
Nervenzellen senden einander Signale über spezialisierte Kontakte, so genannte Synapsen. Wird eine sendende Nervenzelle erregt, so schüttet sie chemische Botenstoffe aus, die aus kleinen, von Membranen umhüllten Vesikeln freigesetzt werden und dann zur Empfängerzelle gelangen. Die Freisetzung der Botenstoffe erfolgt durch Verschmelzen der Vesikel mit der Zellmembran, ein Prozess, der das Zusammenspiel vieler verschiedener Eiweißbausteine der Zelle erfordert.
Bevor die Botenstoff-Vesikel mit der Membran der Nervenzelle verschmelzen können, müssen sie zuerst in einen aktiven Zustand gebracht werden. Der entsprechende biochemische Prozess wird als 'Priming' bezeichnet. Während dieses Prozesses wird eine als SNARE-Komplex bezeichnete Struktur aus Eiweißbausteinen aufgebaut, die für die schnelle Verschmelzung von Vesikeln mit der Zellmembran gebraucht wird.
Wissenschaftler des Max-Planck-Instituts für Experimentelle Medizin in Göttingen unter der Leitung des koreanischen Hirnforschers JeongSeop Rhee haben nun eine neue Methode entwickelt, mit der das 'Priming' von synaptischen Vesikeln direkt gemessen werden kann. Dabei haben sich die Forscher eine Methode zunutze gemacht, die bisher nur in wenigen speziellen Zelltypen verwendet werden konnte. „Anstatt die Nervenzellen elektrisch zu stimulieren, haben wir sie über unser Meßsystem mit einem chemisch verpackten Signal – mit Kalzium-Ionen – befüllt und die Verpackung dann mit einem ultravioletten Lichtblitz zerstört“, erklärt Rhee. Auf diese Weise könne man viele der komplizierten Prozesse, die der Vesikelfusion normalerweise vorausgehen, umgehen. Das Verfahren machten die Wissenschaftler erst dadurch möglich, dass sie Nervenzellen in Petrischalen auf winzigen, nur 0,04 Quadratmillimeter großen Inseln kultivierten.
Mit seiner neuen Methode entdeckte Rhee zusammen mit seinen Mitarbeitern Andrea Burgalossi und Sangyong Jung, dass zwei als SNAPs bezeichnete Eiweißbausteine von Nervenzellen beim Recycling von SNARE-Komplexen an Synapsen eine extrem wichtige Rolle spielen. Ohne SNAPs wird die Wiedergewinnung der einzelnen Komponenten von SNARE-Komplexen blockiert und die Synapsenfunktion dadurch mit der Zeit blockiert.
„Besonders fasziniert sind wir von unserer neuen Methode“, meint JeongSeop Rhee, „weil sie uns bisher nicht da gewesene Einblicke in die Mechanismen der Botenstofffreisetzung aus Synapsen ermöglicht.“ Aber auch die neuen Erkenntnisse über die 'Priming'-Rolle der SNAP-Proteine seien sehr wichtig. „Eine Reihe von Pharmaunternehmen arbeiten an Verfahren, das 'Priming' von synaptischen Vesikeln zu beeinflussen.“ Sollte es gelingen, diesen Prozess pharmakologisch zu regulieren, wären ganz neue Epilepsie-Therapien möglich, die viele der Nebenwirkungen umgehen, unter denen aktuelle Therapieverfahren leiden.
Originalveröffentlichung:
Burgalossi, A., Jung, S., Meyer, G., Jockusch, W.J., Jahn, O., Taschenberger, H., O'Connor, V.M., Nishiki, T., Takahashi, M., Brose, N. und Rhee, J.-S.
SNARE protein recycling by alpha SNAP and beta SNAP supports synaptic vesicle priming.
Neuron, 4. November 2010 (10.1016/j.neuron.2010.09.019)
Weitere Informationen erhalten Sie von:
Dr. JeongSeop Rhee
Max-Planck-Institut für Experimentelle Medizin, Göttingen
Tel.: +49 551 3899-694
E-Mail: rhee@em.mpg.de
Media Contact
Weitere Informationen:
http://www.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Anlagenkonzepte für die Fertigung von Bipolarplatten, MEAs und Drucktanks
Grüner Wasserstoff zählt zu den Energieträgern der Zukunft. Um ihn in großen Mengen zu erzeugen, zu speichern und wieder in elektrische Energie zu wandeln, bedarf es effizienter und skalierbarer Fertigungsprozesse…

Ausfallsichere Dehnungssensoren ohne Stromverbrauch
Um die Sicherheit von Brücken, Kränen, Pipelines, Windrädern und vielem mehr zu überwachen, werden Dehnungssensoren benötigt. Eine grundlegend neue Technologie dafür haben Wissenschaftlerinnen und Wissenschaftler aus Bochum und Paderborn entwickelt….

Dauerlastfähige Wechselrichter
… ermöglichen deutliche Leistungssteigerung elektrischer Antriebe. Überhitzende Komponenten limitieren die Leistungsfähigkeit von Antriebssträngen bei Elektrofahrzeugen erheblich. Wechselrichtern fällt dabei eine große thermische Last zu, weshalb sie unter hohem Energieaufwand aktiv…





















