Struktur einer altertümlichen biologischen Uhr enthüllt
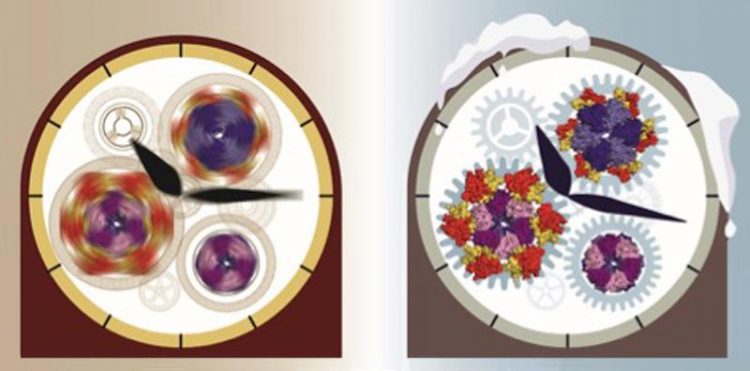
Die molekularen Strukturen der ‚eingefrorenen’ biologischen Uhr von Cyanobakterien konnten Forscher mit Hilfe der Kryo-Elektronenmikroskopie im Detail entschlüsseln. Illustration: P. Lössl
Bereits seit zehn Jahren wissen wir, dass die biologische Uhr der Cyanobakterien aus nur drei Proteinbestandteilen KaiA, KaiB und KaiC aufgebaut ist. Diese Proteine bilden die Grundbausteine eines präzisen Uhrwerks und entsprechen damit den Zahnrädern, den Federn und dem Schwungrad einer mechanischen Uhr.
Wird diesem System Energie zugeführt – ähnlich dem Aufziehen einer Uhr ‒ bilden diese drei Proteine, ohne weitere äußere Einwirkung, den Tag-Nacht-Rhythmus nach. Im Reagenzglas ist ein solch isoliertes System über Wochen stabil. Bereits 2005 beschrieben japanische Wissenschaftler dieses Phänomen, jedoch war bis heute unklar wie diese drei ‚Uhr’-Proteine dies zusammen tatsächlich bewerkstelligen.
In der aktuellen Studie nahmen sich nun die Wissenschaftler vom Max-Planck-Institut für Biochemie und der Universität Utrecht der Aufklärung dieser Aufgabe an. Dafür setzten sie modernste Methoden der molekularen Strukturanalyse ein, wie die der nativen Massenspektrometrie und der Kryo-Elektronenmikroskopie.
William Faulkner
Doch wie konnten die Wissenschaftler jetzt die Funktion der einzelnen Teile aufklären? „Um das ticken der biologischen Uhr in Cyanobakterien zu verstehen, haben wir im übertragenen Sinne die Zeit gestoppt“, erklärt der Forschungsleiter Heck aus Utrecht.
„Oder wie William Faulkner, Nobelpreisträger für Literatur einst sagte: 'Nur wenn die Uhr anhält, kommt die Zeit ins Leben.' Faulkner sprach vom Innehalten in der ständigen Hast des Lebens. Das war auch bei uns der Trick. Wir haben die biologische Uhr gestoppt indem wir sie eine Woche lang in den Kühlschrank gelegt haben. Im sprichwörtlichen Sinne haben wir die Zeit eingefroren.“
Hereingezoomt
Die molekularen Strukturen dieser ‚eingefrorenen’ Uhr konnten die Forscher mit Hilfe der Kryo-Elektronenmikroskopie im Detail untersuchen. So gelang es die Position dieser ‚Uhr’-Proteine im Uhrwerk zu bestimmen und zu verstehen, wie die einzelnen Komponenten – der Antrieb, die Feder und das Schwungrad ‒ dieser biologischen Uhr zusammenarbeiten. Die native Massenspektrometrie ermöglichte es dahingegen, die Häufigkeit des komplexen Ab- und Aufbaus dieser drei Proteine KaiA, KaiB und KaiC während eines 24-Stunden Zyklus aufzuklären und die rhythmusgebenden Proteinkomponenten zu bestimmen.
„Obwohl die biologische Uhr der Cyanobakterien erdgeschichtlich sehr alt ist können wir auch heute aus diesem System viel lernen“, so Heck. Vor wenigen Jahren entdeckten Forscher einen ähnlichen Mechanismus in unseren roten Blutzellen.
„Cyanobakterien waren die ersten Sauerstoff produzierenden Organismen und haben damit die Grundlage für unser heutiges Leben geschaffen. Die Erkenntnisse dieser Studie bieten neue Einblicke in die biologischen ‚U(h)r’-Mechanismen des Lebens und bestimmte Aspekte können wir direkt in der klinischen Forschung weiter verfolgen“, fasst Heck zusammen.
Originalpublikation:
J. Snijder, J.M. Schuller, A. Wiegard, P. Lössl, N. Schmelling, I.M.Axmann, J.M. Plitzko, F. Förster and A.J.R. Heck: Structures of the cyanobacterial circadian oscillator frozen in a fully assembled state, Science, März 2017
Kontakt:
Prof. Dr. Jürgen Plitzko
Abteilung Strukturbiologie
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
E-Mail: plitzko@biochem.mpg.de
www.biochem.mpg.de/baumeister
Dr. Christiane Menzfeld
Öffentlichkeitsarbeit
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
Tel. +49 89 8578-2824
E-Mail: pr@biochem.mpg.de
www.biochem.mpg.de
http://www.biochem.mpg.de – Webseite des Max-Planck-Institutes für Biochemie
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















