Simultantests zeigen spezifische Wirkungen der Sirtuine
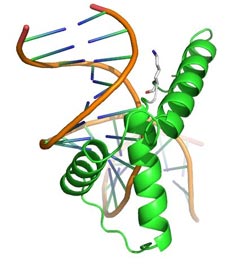
Die Grafik zeigt ein Protein, das die Forschungsgruppe um Prof. Dr. Clemens Steegborn als Sirt1-Substrat identifiziert hat. Es ist ein DNA-bindendes Protein, die DNA ist orange dargestellt. Bei der Deacetylierungsstelle handelt es sich um den einzelnen grauen Strang rechts oben. Grafik: Prof. Dr. Clemens Steegborn; zur Veröffentlichung frei.<br>
So gibt es im menschlichen Organismus relativ wenige Proteine, auf die verschiedene Sirtuine die gleiche deacetylierende Wirkung ausüben. Über ihre Erkenntnisse, die sie in Simultantests an mehr als 6.800 Proteinacetylierungsstellen erzielt haben, berichten die Wissenschaftler in der aktuellen Ausgabe des Wissenschaftsmagazins „Nature Communications“.
Sirtuine sind Enzyme, die insbesondere die Funktion haben, Stoffwechsel- und Alterungsprozesse zu steuern. Sie tun dies, indem sie an ausgewählten Stellen lebenswichtiger Proteine Acetylgruppen abspalten. Diese Deacetylierung hat eine Signalwirkung für zahlreiche Vorgänge in lebenden Zellen, beispielsweise für die Erzeugung neuer Proteine aufgrund genetischer Informationen oder für den Abbau von Nährstoffen. Im Organismus des Menschen lassen sich sieben verschiedene Sirtuine unterscheiden, sie werden in der Forschung als „Sirt1“ bis „Sirt7“ bezeichnet.
Ihre Wirkungsweise durch pharmakologische Wirkstoffe zielgenau zu fördern oder auch zu hemmen, ist derzeit noch ein visionäres Ziel. Doch weltweit, und unter der Leitung von Prof. Dr. Clemens Steegborn auch an der Universität Bayreuth, arbeiten Forschungsgruppen aus Biochemie und Biomedizin darauf hin, diese Vision Wirklichkeit werden zu lassen.
Breit angelegte Simultantests mit Peptidarrays:
Zuverlässige Rückschlüsse auf Prozesse im menschlichen Organismus
Um geeignete Wirkstoffe entwickeln zu können, sind zunächst einmal detailliertere Kenntnisse über die Wirkungsweise von Sirtuinen erforderlich. Insbesondere muss in Bezug auf jedes der Sirtuine 1 bis 7 geklärt werden, auf welche Proteine es eine deacetylierende Wirkung ausübt. Gibt es im menschlichen Organismus eine große Anzahl von Proteinen, die durch mehrere Sirtuine deacetyliert werden? Oder gibt es nur wenige solcher Proteine, weil jedes Sirtuin eine weitgehend spezifische Wirkung hat?
Diese grundsätzliche Frage konnten die Forscher, die in „Nature Communications“ über ihre Forschungsergebnisse berichten, jetzt definitiv beantworten. Sie haben mehr als 6.800 Anheftungsstellen für Acetylgruppen in Proteinen, die den Sirtuinen 1 bis 7 als „Angriffsflächen“ dienen können, zeitgleich daraufhin untersucht, durch welche Sirtuine sie tatsächlich deacetyliert werden. Dabei wurden nicht die vollständigen Proteinmoleküle verwendet, sondern nur die acetylierten Abschnitte dieser Proteine. Es handelt sich hierbei um Peptide, die aus den im Menschen tatsächlich vorkommenden Proteinen stammen, so dass die Tests zuverlässige Rückschlüsse auf die deacetylierende Wirkung der Proteine im menschlichen Organismus zulassen.
Bei diesen breit angelegten Simultantests kamen spezielle Peptidarrays zum Einsatz, die eine Forschungsgruppe unter der Leitung von Prof. Dr. Mike Schutkowski an der Martin-Luther-Universität Halle-Wittenberg entwickelt hat. Es handelt sich dabei um Mikrochips, auf denen mehr als 6800 Proteinabschnitte auf engstem Raum Platz finden. Die Forscher haben die Oberflächen dieser Chips mit den Sirtuinen 1 bis 7 in Kontakt gebracht. So konnten sie in kürzester Zeit feststellen, auf welche Proteine die Sirtuine jeweils eine deacetylierende Wirkung haben.
Spezifische Substrate der sieben Sirtuine:
„Eine Ermutigung für die weitere biomedizinische Forschung an Sirtuinen“
Das Ergebnis war überraschend. Jedes Sirtuin im menschlichen Organismus übt eine deacetylierende Wirkung auf Proteine aus, von denen die meisten durch kein anderes Sirtuin derart stark verändert werden. Oder anders ausgedrückt: Jedes der Sirtuine 1 bis 7 hat seine spezifischen Substrate. So konnten die Forscher beispielsweise bestätigen, dass Malatdehydrogenase – ein für den Stoffwechsel unentbehrliches Enzym – allein durch Sirt 3 deacetyliert wird. Andererseits haben sie aber auch entdeckt, dass Peroxiredoxin 1 – ein Enzym, das in der Zelle den Abbau von giftigem Wasserstoffperoxid fördert – sowohl durch Sirt1 als auch durch Sirt5 deacetyliert wird, also ein Substrat beider Sirtuine sein kann.
„Insgesamt gesehen, sind die Erkenntnisse, die wir mithilfe unserer Simultantests erzielen konnten, eine Ermutigung für die weitere biomedizinische Forschung an Sirtuinen“, erklärt Prof. Steegborn. „Denn wenn sich die Sirtuine hinsichtlich ihrer Wirkungen relativ klar unterscheiden lassen, sinkt tendenziell das Risiko, dass Substanzen, die ein Sirtuin aktivieren oder hemmen, unerwünschte Nebenwirkungen erzeugen. Vor allem aber sind die Deacetylierungs-Daten, die wir mithilfe der Peptidarrays gewonnen haben, eine Fundgrube für die weitere Sirtuinforschung. Wann immer es darum geht, einen sirtuingesteuerten Stoffwechsel- oder Alterungsprozess durch pharmakologische Wirkstoffe gezielt zu beeinflussen, wissen wir jetzt genauer, wo diese Wirkstoffe ansetzen müssen: bei genau demjenigen Sirtuin, das den jeweiligen Prozess durch Deacetylierung eines Proteins auslöst oder in Gang hält.“
Veröffentlichung:
David Rauh, Frank Fischer, Melanie Gertz, Mahadevan Lakshminarasimhan, Tim Bergbrede, Firouzeh Aladini, Chistian Kambach, Christisan F.W. Becker, Christian F.W. Becker, Johannes Zerweck, Mike Schutkowski and Clemens Steegborn,
An acetylome peptide microarray reveals specificities and deacetylation substrates for all human sirtuin isoforms,
in: Nature Communications, Published 02 September 2013, DOI: 10.1038/ncomms3327
Ansprechpartner:
Prof. Dr. Clemens Steegborn
Lehrstuhl für Biochemie
Universität Bayreuth
D-95440 Bayreuth
Telefon: +49 (0)921 55 7830
E-Mail: clemens.steegborn@uni-bayreuth.de
Media Contact
Weitere Informationen:
http://www.uni-bayreuth.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Ideen für die Zukunft
TU Berlin präsentiert sich vom 22. bis 26. April 2024 mit neun Projekten auf der Hannover Messe 2024. Die HANNOVER MESSE gilt als die Weltleitmesse der Industrie. Ihr diesjähriger Schwerpunkt…

Peptide auf interstellarem Eis
Dass einfache Peptide auf kosmischen Staubkörnern entstehen können, wurde vom Forschungsteam um Dr. Serge Krasnokutski vom Astrophysikalischen Labor des Max-Planck-Instituts für Astronomie an der Universität Jena bereits gezeigt. Bisher ging…

Wasserstoff-Produktion in der heimischen Garage
Forschungsteam der Frankfurt UAS entwickelt Prototyp für Privathaushalte: Förderzusage vom Land Hessen für 2. Projektphase. Wasserstoff als Energieträger der Zukunft ist nicht frei verfügbar, sondern muss aufwendig hergestellt werden. Das…





















