RUB-Forscher entdecken Schutzprotein gegen Chlor
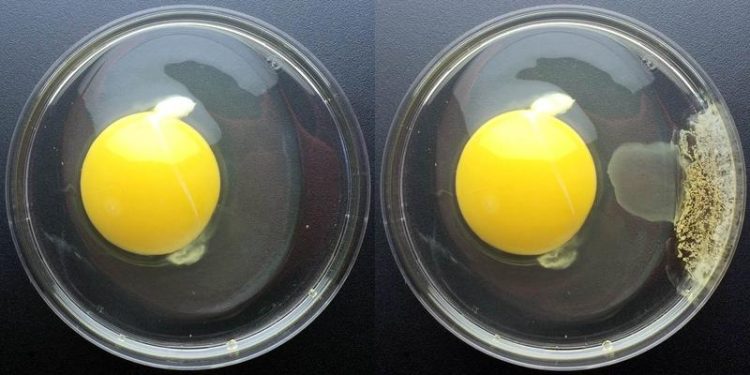
Ein unbehandeltes Ei (links) im Vergleich zu einem Ei, das mit einem Tropfen Chlorbleiche behandelt wurde rechts): Diese lässt die Proteine verklumpen. © RUB, Abt. Biochemie der Mikroorganismen
Chlor ist ein gängiges Desinfektionsmittel, das Bakterien tötet, etwa im Schwimmbad oder der Trinkwasserversorgung. Auch unser Immunsystem stellt Chlor her, das dazu führt, dass Proteine in Bakterien ihre natürlich Faltung verlieren, verklumpen und nicht mehr funktionieren.
Zellen unter Sauerstoffstress
Die Forscher interessieren sich für oxidativen Stress, der auf Zellen einwirkt, wenn sie so genannten reaktiven Sauerstoffspezies ausgesetzt werden. Oxidativer Stress spielt zum Beispiel eine Rolle bei der Zellalterung, aber auch bei der Immunabwehr. Immunzellen produzieren reaktive Sauerstoffspezies und setzen damit Bakterien unter oxidativen Stress. Was aber passiert dann in den Bakterien, ganz besonders mit ihren Proteinen? Dieser Frage gehen die Forscher nach, indem sie gezielt nach Proteinen suchen, die sich durch oxidativen Stress verändern. So wurden sie auf das Protein RidA aufmerksam.
RidA ändert seine Funktion in Gegenwart von Chlor
„Jedes Protein hat eine Funktion“, erklärt Lars Leichert. RidA ist dafür zuständig, dass bei der Herstellung von bestimmten Aminosäuren ein Zwischenprodukt schneller abgebaut wird. Um herauszufinden, was mit RidA bei oxidativem Stress passiert, setzten die Forscher es allen möglichen reaktiven Spezies aus, die von Immunzellen hergestellt werden, darunter auch Chlor. Bestimmte reaktive Spezies inaktivieren RidA, das heißt das Zwischenprodukt wurde wie erwartet von RidA nicht mehr abgebaut.
Mit Chlor behandeltes RidA sorgte aber dafür, dass das Zwischenprodukt gar nicht erst hergestellt wurde. „Dafür konnten wir nur eine Erklärung finden: Mit Chlor behandeltes RidA bindet fest an das Protein, welches das Zwischenprodukt herstellt“, erklärt Alexandra Müller aus Leicherts Team. Anders gesagt: RidA wird in Anwesenheit von Chlor zu einem so genannten Chaperon.
Mit RidA trübt sich die Proteinlösung nicht
In dieser Funktion kann es andere Proteine beschützen: Wenn sich Proteine entfalten – das tun sie zum Beispiel wenn sie mit Chlor in Kontakt kommen oder erhitzt werden –, dann verklumpen sie. Das führt dazu, dass eine Proteinlösung trüb wird. „Bei einem Ei ist das besonders eindrucksvoll. Das durchsichtige Eiklar wird weiß und undurchsichtig, wenn sich die Proteine beim Kochen darin entfalten“, beschreibt Lars Leichert. Die Forscher können diese Trübung mit einem Fluoreszenzspektrometer genau messen. Wenn man aber mit Chlor behandeltes RidA dazu gibt, bleibt dieselbe Lösung klar. Verklumpte Proteine funktionieren nicht mehr – aus einem gekochten Ei schlüpft kein Küken. Ein Chaperon kann das Verklumpen verhindern und schützt deswegen die Zelle.
Klebriges Protein bindet an alle anderen
Darüber hinaus haben die Forscher auch herausgefunden, dass RidA nach dem Ende der Bedrohung durch Chlor die Proteine auch wieder loslassen kann, so dass sie ihre Funktion wieder ausüben können. Bei erneuter Chlor-Bedrohung bindet RidA wieder an Proteine. Außerdem wollten die Forscher wissen, wie genau RidA zum Chaperon wird. Experimente ergaben, dass die sogenannte N-Chlorinierung dazu führt, dass RidA viel hydrophober wird. Je hydrophober ein Protein ist, desto „klebriger“ wird es und umso besser können entfaltete Proteine daran binden. RidA schützt in diesem klebrigen Zustand die Proteine in der Bakterienzelle vor dem Verklumpen.
Forscher vermuten eine Rolle bei der Immunabwehr
Für den Einsatz von Chlor als Desinfektionsmittel hat das aber keine Folgen: RidA hilft Bakterien nur bei sehr geringen Chlormengen. Anders als bei Antibiotika gibt es bei Desinfektionsmitteln keine Resistenzen. „Wir denken, dass durch Chlor aktivierte Chaperone vor allem beim Zusammentreffen von Bakterien mit der Immunabwehr eine Rolle spielen“, sagt Lars Leichert.
Titelaufnahme
A. Müller, S. Langklotz, N. Lupilova, K. Kuhlmann, J. Bandow, L. Leichert (2014): Activation of RidA chaperone function by N-chlorination, Nature Communications, DOI: 10.1038/ncomm6804
Weitere Informationen
Prof. Dr. Lars Leichert, Medizinische Fakultät der RUB, Abteilung für Biochemie der Mikroorganismen, Tel. 0234/32-24585, E-Mail: lars.leichert@rub.de
Redaktion: Meike Drießen
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Merkmale des Untergrunds unter dem Thwaites-Gletscher enthüllt
Ein Forschungsteam hat felsige Berge und glattes Terrain unter dem Thwaites-Gletscher in der Westantarktis entdeckt – dem breiteste Gletscher der Erde, der halb so groß wie Deutschland und über 1000…

Wasserabweisende Fasern ohne PFAS
Endlich umweltfreundlich… Regenjacken, Badehosen oder Polsterstoffe: Textilien mit wasserabweisenden Eigenschaften benötigen eine chemische Imprägnierung. Fluor-haltige PFAS-Chemikalien sind zwar wirkungsvoll, schaden aber der Gesundheit und reichern sich in der Umwelt an….

Das massereichste stellare schwarze Loch unserer Galaxie entdeckt
Astronominnen und Astronomen haben das massereichste stellare schwarze Loch identifiziert, das bisher in der Milchstraßengalaxie entdeckt wurde. Entdeckt wurde das schwarze Loch in den Daten der Gaia-Mission der Europäischen Weltraumorganisation,…





















