Röntgenlaser liefert Bauplan für mögliches Mittel gegen Schlafkrankheit
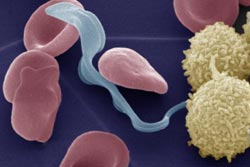
Kolorierte Elektronenmikroskopaufnahme des Parasiten Trypanosoma brucei (hellblau) im Blut, zusammen mit roten und weißen Blutkörperchen (Erythrozyten, rot, und Lymphozyten, weiß). Die Parasiten werden durch den Biss der Tsetse-Fliege übertragen und leben im Blut, bevor sie das zentrale Nervensystem und das Hirn angreifen, was in der Regel tödlich verläuft.<br><br>Bild: Prof. Michael Duszenko, Universität Tübingen<br>
Die detaillierte Analyse liefert den Bauplan für ein mögliches Mittel gegen den Parasiten Trypanosoma brucei, der mehr als 60 Millionen Menschen vor allem im südlichen Afrika bedroht. Es ist die erste neue biologische Strukturinformation, die mit einem sogenannten Freie-Elektronen-Laser gewonnen wurde.
Mit einem maßgeschneiderten molekularen Stöpsel ließe sich demnach ein lebenswichtiges Enzym des Parasiten blockieren, wie das Team um DESY-Forscher Prof. Henry Chapman vom Center for Free-Electron Laser Science (CFEL), Prof. Christian Betzel von der Universität Hamburg und Dr. Lars Redecke von der gemeinsamen Nachwuchsgruppe „Strukturelle Infektionsbiologie unter Anwendung neuer Strahlungsquellen (SIAS)“ der Universitäten Hamburg und Lübeck, im Fachjournal „Science“ berichtet. „Dies ist die erste neue biologische Struktur, die an einem Freie-Elektronen-Laser entschlüsselt wurde“, betont Chapman.
Die Wissenschaftler hatten das Enzym Cathepsin B des Parasiten in kristallisierter Form mit den intensiven Röntgenblitzen der Linac Coherent Light Source LCLS am US-Forschungszentrum SLAC in Kalifornien analysiert. „Das Enzym hatte sich in früheren Untersuchungen als vielversprechender Ansatzpunkt für ein Medikament erwiesen“, erläutert Dr. Lars Redecke, einer der beiden Hauptautoren der „Science“-Studie. „Das Ausschalten des Enzyms im Parasiten konnte bei Mäusen die Infektion heilen.“
Allerdings kommt dasselbe Enzym auch beim Menschen und sogar bei allen Säugetieren vor. Legt man es unspezifisch lahm, kann das auch für den Patienten gravierende Konsequenzen haben. Mit ihrer Röntgenuntersuchung haben die Forscher nun jedoch charakteristische Unterschiede in der molekularen Struktur des Enzyms zwischen Mensch und Parasit gefunden. „Damit eröffnet sich grundsätzlich die Chance, mit einem maßgeschneiderten Molekül gezielt das Enzym des Parasiten zu blockieren, es aber beim Patienten intakt zu lassen“, erläutert der andere Hauptautor der „Science“-Studie, Karol Nass, Doktorand an der Hamburg School for Structure and Dynamics in Infection (SDI), die von der Landesexzellenzinitiative (LEXI) gefördert wird. Trotz dieses vielversprechenden Ansatzes sei ein mögliches neues Medikament allerdings noch sehr weit entfernt, betonen die Wissenschaftler.
Die Schlafkrankheit, wissenschaftlich als Humane Afrikanische Trypanosomiasis (HAT) bezeichnet, wird durch den Biss der Tsetse-Fliege übertragen. Die Trypanosomen verschanzen sich im zentralen Nervensystem, und ohne Behandlung verläuft die Infektion normalerweise tödlich. Die Krankheit kommt in 36 afrikanischen Ländern südlich der Sahara vor und gefährdet vor allem die arme Landbevölkerung. In den vergangenen Jahren wurde der Kampf gegen die Krankheit unter Federführung der Weltgesundheitsorganisation WHO deutlich verstärkt, wodurch die Fallzahlen drastisch gesunken sind. Dennoch sind nach wie vor Millionen Menschen gefährdet.
Die Schlafkrankheit wird mit Anti-Parasiten-Medikamenten behandelt, die allerdings ohne genaue Kenntnis der biochemischen Zusammenhänge entwickelt worden und daher weniger zuverlässig und sicher seien als wünschenswert, unterstreichen die Wissenschaftler. Außerdem würden immer mehr Parasiten widerstandsfähig gegen die Mittel. Neue Wirkstoffe, die gezielt die Parasiten töten ohne den Organismus des Patienten zu beeinträchtigen, wären daher von großem Nutzen.
Zur Entschlüsselung der Cathepsin-B-Struktur durchleuchtete das Forscherteam kleine Kristalle aus dem Biomolekül mit der intensiven Röntgenstrahlung. Kristalle streuen Röntgenlicht generell auf charakteristische Weise, und aus den resultierenden Beugungsbildern lässt sich die Struktur des Kristalls und damit in diesem Fall des Enzyms berechnen. Dank der hellen Röntgenblitze konnten die Wissenschaftler die molekulare Struktur des Enzyms mit atomarer Auflösung bestimmen.
Auch wenn diese Art der Röntgenkristallographie von Biomolekülen heute zu den Standardmethoden gehört, gibt es viele Proteine, die im Labor schwer zu kristallisieren sind, wie etwa Cathepsin B. Die Forscher verfolgten daher einen neuartigen Ansatz: Sie ließen Insektenzellen die Enzymkristalle in vivo herstellen. Im Gegensatz zur üblichen Kristallisation, bei der Bakterien das gewünschte Biomolekül herstellen und es nachträglich mit viel Ausschuss im Labor zu möglichst großen Einheiten kristallisiert wird, lieferte nur die In-vivo-Technik, die in den Laboren von Betzel und von Prof. Michael Duszenko an der Universität Tübingen entwickelt wurde, brauchbare Kristalle.
Darüber hinaus hat die In-vivo-Kristallisation in Insektenzellen einen weiteren, entscheidenden Vorteil: Auf diese Weise wurde das Cathepsin B in seiner natürlichen Konfiguration „eingefroren“. Das Enzym arbeitet als eine Art molekulare Schere, die andere Proteine zerteilt. Es wird daher im Organismus in einer inaktivierten Form hergestellt, bei der ein kleines Eiweißmolekül, ein sogenanntes Peptid, die Schere blockiert. Erst wenn die Schere gebraucht wird, aktiviert die Zelle das Enzym und löst das Peptid.
„Dank des angekoppelten Peptids konnten wir unter einen bislang unzugänglichen Strukturbereich des Cathepsins schauen“, erläutert Betzel. Dort enthüllte die Analyse deutliche Unterschiede der Peptid-Bindungsstellen am Cathepsin B zwischen Parasit und Mensch, die sich für einen maßgeschneiderten künstlichen Hemmstoff nutzen lassen, der gezielt das Parasiten-Enzym blockiert. „Auf diese Weise hat uns die Natur einen grundlegenden Bauplan dafür geliefert, wie ein künstlicher Hemmstoff für das Enzym des Parasiten aussehen könnte.“ Der nächste Schritt wäre die Herstellung und der Test eines solchen Hemmstoffs im Labor.
Die untersuchten Enzymkristalle waren etwa einen tausendstel Millimeter (einen Mikrometer) dick und im Schnitt zehn Mikrometer lang. Das ist immer noch so klein, dass nur die hellsten Röntgenquellen wie die LCLS ausreichend detaillierte Beugungsbilder für eine Strukturanalyse mit atomarer Auflösung produzieren. Die LCLS gehört zu einer neuen Generation von Forschungslichtquellen. Diese sogenannten Freie-Elektronen-Laser beruhen auf starken Teilchenbeschleunigern, die zunächst Elektronen auf hohe Energien bringen und sie dann durch einen enggesteckten Slalomkurs schicken. In jeder Kurve senden die Elektronen kleine Röntgenblitze aus, die sich zu einem extrem starken Laserpuls verstärken, der dann winzige Strukturen wie Enzyme und andere Biomoleküle entschlüsseln kann. In Hamburg entsteht mit dem Freie-Elektronen-Laser European XFEL, bei dem DESY Hauptgesellschafter ist, zurzeit der beste Röntgenlaser der Welt.
Um die Struktur der Peptid-Bindestelle am Cathepsin B zu bestimmen, mussten die Forscher Hunderttausende Beugungsbilder aufnehmen und nachträglich zusammenfügen, wobei jedes Bild immer nur einen Teil der Struktur liefert. Da die Kristalle durch den Beschuss mit den Röntgenblitzen sofort verdampfen, ließen die Forscher Millionen von Kristallen in einem feinen Wasserstrahl durch den Strahl des Röntgenlasers rieseln. Der Röntgenlaser feuerte 120 Blitze pro Sekunde auf den Strahl, im Schnitt traf jeder elfte einen Kristall. So entstanden insgesamt 293 195 Beugungsbilder, die nur mit einem großen Parallelrechner verarbeitet werden konnten. Die Kombination ergibt zunächst eine dreidimensionale Karte der kompletten Streueigenschaften des Enzyms, aus der sich seine Struktur bis auf 2,1 Ångström genau berechnen ließ (ein Ångström ist ein zehntel Nanometer, das entspricht einem zehnmillionstel Millimeter). „Interessanterweise fällt unsere Entdeckung gerade mit dem hundertsten Jubiläum der Veröffentlichung der berühmten Röntgenbeugungsgleichung durch William Bragg im Jahr 1912 zusammen“, betont Chapman.
Dem Forscherteam gehörten Wissenschaftler von DESY, den Universitäten Hamburg, Lübeck, Tübingen, Uppsala und Göteborg sowie der Arizona State University, dem US-Beschleunigerzentrum SLAC, dem Lawrence Livermore National Laboratory (USA), dem Max-Planck-Institut für medizinische Forschung in Heidelberg und der Max Planck Advanced Study Group am Hamburger Center for Free-Electron Laser Science (CFEL) an. Das CFEL ist eine Kooperation von DESY, der Max-Planck-Gesellschaft und der Universität Hamburg. DESY ist ein Forschungszentrum der Helmholtz-Gemeinschaft. Es ist das führende deutsche Beschleunigerzentrum und eines der führenden in der Welt.
Originalveröffentlichung: „Natively inhibited Trypanosoma brucei cathepsin B structure determined using an x-ray laser“; Lars Redecke, Karol Nass et al.; „Science“, 2012 (advance online publication); DOI: 10.1126/science.1229663
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Ideen für die Zukunft
TU Berlin präsentiert sich vom 22. bis 26. April 2024 mit neun Projekten auf der Hannover Messe 2024. Die HANNOVER MESSE gilt als die Weltleitmesse der Industrie. Ihr diesjähriger Schwerpunkt…

Peptide auf interstellarem Eis
Dass einfache Peptide auf kosmischen Staubkörnern entstehen können, wurde vom Forschungsteam um Dr. Serge Krasnokutski vom Astrophysikalischen Labor des Max-Planck-Instituts für Astronomie an der Universität Jena bereits gezeigt. Bisher ging…

Wasserstoff-Produktion in der heimischen Garage
Forschungsteam der Frankfurt UAS entwickelt Prototyp für Privathaushalte: Förderzusage vom Land Hessen für 2. Projektphase. Wasserstoff als Energieträger der Zukunft ist nicht frei verfügbar, sondern muss aufwendig hergestellt werden. Das…





















