Regulation von Botenstoffen der Entzündung
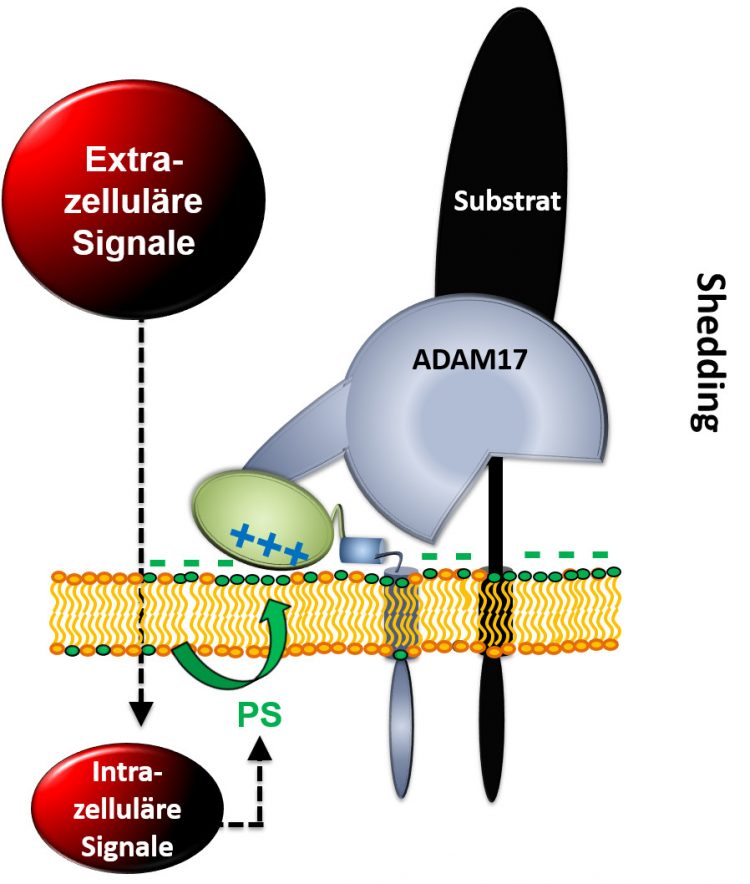
Extrazelluläre Signale führen dazu, dass das negativ geladene Phospholipid Phosphatidylserin (PS) von der Innenseite der Membran nach außen kommt. Die Protease ADAM17 kann in diesem Moment mit PS elektrostatisch interagieren und wird so in die Lage versetzt, Substrate (z.B. TNF-α) freizusetzen. Durch Freisetzung von TNF α werden Entzündungsreaktionen in unserem Körper entscheidend beeinflusst. Grafik: Dr. Anselm Sommer
Tumornekrosefaktor-alpha (TNF-α) ist ein zentraler Signalstoff des Immunsystems und an vielen Entzündungsprozessen beteiligt. Die Blockade dieses Moleküls ist Grundlage moderner Therapeutika gegen Entzündungskrankheiten wie Rheuma, Schuppenflechte oder chronisch-entzündliche Darmerkrankungen. Welcher molekulare Mechanismus der Freisetzung und damit Aktivierung von TNF-α zugrunde liegt, hat jetzt erstmals eine Arbeitsgruppe des Exzellenzclusters Entzündungsforschung an der Medizinischen Fakultät der Christian-Albrechts-Universität zu Kiel (CAU) aufgeklärt.
Dem Team unter Leitung der Zellbiologin Professorin Karina Reiß ist damit eine Pionierleistung gelungen. Denn das entdeckte Prinzip ist von grundlegender Bedeutung und eröffnet ein komplett neues Forschungsfeld in der Zellbiologie. Abgesehen davon liefert die kürzlich in Nature Communications publizierte Studie neue Ansatzpunkte für die Entwicklung antientzündlicher Therapien.
Seit die zentrale Rolle von Tumornekrosefaktor-alpha (TNF-α) im Entzündungsgeschehen bekannt ist, versuchen Arbeitsgruppen auf der ganzen Welt zu verstehen, wie dieses wichtige Molekül im Körper reguliert wird. Ein Meilenstein in diesem Zusammenhang war eine Entdeckung aus dem Jahr 1997. Damals wurde das Enzym entdeckt, das TNF-αfreisetzt. Das Enzym namens ADAM17 sitzt auf der Zelloberfläche und „schneidet“ dort TNF-α von der in der Membran verankerten Vorstufe ab, so dass es an anderen Zellen seine Wirkung entfalten kann. Neben TNF-α spaltet ADAM17 auch viele andere in der Membran sitzenden Moleküle und überführt diese dadurch in eine lösliche Form.
„Die Protease schneidet Substrate direkt über der Zellmembran ab. Dann können diese nun freigesetzten Proteine an Rezeptoren auf anderen Zellen binden. So wird durch die Protease ADAM17 unglaublich viel in unserem Körper reguliert“, erklärt Karina Reiß, die seit 2008 als Professorin für epitheliale Proteaseinhibitoren im Exzellenzcluster Entzündungsforschung an der Klinik für Dermatologie, Venerologie und Allergologie, Medizinische Fakultät der CAU und Universitätsklinikum Schleswig-Holstein (UKSH), forscht. Es wurden bereits sehr viele Substrate identifiziert, die ADAM17 spaltet. Diese spielen zum Beispiel bei der Zellproliferation, also dem Wachstum von Gewebe, und bei der Immunreaktion eine Rolle.
Seit der Entdeckung von ADAM17 als TNF- α freisetzendes Enzym erhofft man sich von der weiteren Charakterisierung dieser Protease Fortschritte für die Therapie zum Beispiel von Menschen mit chronischen Entzündungen des Darms (Morbus Crohn, Colitis ulcerosa), der Haut (Psoriasis) oder der Gelenke (rheumatoide Arthritis). Grundlegende Fragen sind: Wann fängt dieses Enzym an, etwas von der Zelloberfläche abzuschneiden, und wie funktioniert das im Detail? Durch welche Substanzen die Protease aktiviert wird, also wann sie anfängt, etwas abzuschneiden, ist mittlerweile erforscht. „Aber wie das auf molekularer Ebene funktioniert, hat noch keiner verstanden. Hier haben wir einen wichtigen Beitrag geleistet. Wir können zum ersten Mal den Mechanismus beschreiben, wie ADAM17 aktiviert wird, und tragen damit wesentlich zum Verständnis der Regulation dieses wichtigen Enzyms bei“, erklärt Reiß.
Eine Schlüsselrolle in dem Prozess hat ein Bestandteil der Zellmembran, das Lipidmolekül Phosphatidylserin, kurz PS. Die überwiegend aus Phospholipiden bestehende Zellmembran ist asymmetrisch aufgebaut. Bestimmte Lipide befinden sich nur innen und andere nur außen in der Doppelschicht der Membran. Das negativ geladene Lipidmolekül PS sitzt auf der Innenseite der Membran. Dort können positiv geladene Proteine durch elektrostatische Anziehung andocken, wodurch deren Funktion reguliert wird.
„Wir haben beobachtet, dass das negativ geladene Phosphatidylserin unter bestimmten Umständen kurzfristig nach außen kommt, also quasi umklappt. Dadurch entsteht außen eine negative Ladung. ADAM17 hat positive Ladungen, die mit dieser negativen Ladung interagieren. Das ist der entscheidende Mechanismus, der die Protease aktiviert, damit sie etwas abschneidet“, erklärt Dr. Anselm Sommer, Postdoktorand der Arbeitsgruppe und Erstautor der Studie. Für intrazelluläre Proteine sei bekannt, dass deren Funktion über elektrostatische Anziehung an PS reguliert wird, nicht jedoch für Proteine auf der Außenseite der Zelle. Reiß weiter: „Insofern ist das ein neues, grundlegendes Prinzip in der Zellbiologie, das wir da entdeckt haben.“ Denn es sei gut möglich, dass nicht nur die Protease ADAM17, sondern auch andere Proteine durch dieses nach außen Drehen von PS in ihrer Funktion beeinflusst werden.
Nachgewiesen haben die Forschenden den Mechanismus in Zellkulturstudien mit Substanzen, von denen bekannt ist, dass sie ADAM17 aktivieren. „Wir haben viele bekannte Aktivatoren von ADAM17 auf die Zellen gegeben und konnten im Mikroskop mit Hilfe eines PS-bindenden Farbstoffs beobachten, dass sich PS dabei von innen nach außen bewegt.“ Außerdem wurde der Bereich des ADAM17-Moleküls identifiziert, der mit den negativen Ladungen von PS interagiert. In einem nächsten Schritt sind Studien im Mausmodell geplant, die das neu entdeckte Prinzip auch im lebenden Organismus nachweisen sollen. Ermöglicht und gefördert wurde diese Studie mit Mitteln des Exzellenzclusters Entzündungsforschung, des SFB 877 „Proteolyse als regulatorisches Element in der Pathophysiologie“ und des Graduiertenkolleg 1743 „Gene, Umwelt und Entzündung“.
Originalpublikation:
Sommer, A. et al. Phosphatidylserine exposure is required for ADAM17 sheddase function. Nat. Commun. 7:11523 doi: 10.1038/ncomms11523 (2016), published 10. 2016.
http://inflammation-at-interfaces.de/de/newsroom/karinareissundanselmsommer.jpg
Prof. Dr. Karina Reiß (hinten) und Dr. Anselm Sommer, Exzellenzcluster Entzündungsforschung und Klinik für Dermatologie, Venerologie und Allergologie UKSH Kiel, erforschen Enzyme (Proteasen) und deren Hemmstoffe, die von Bedeutung für Entzündungskrankheiten sind. Foto: Kerstin Nees
http://inflammation-at-interfaces.de/de/newsroom/A17SchemaV2.jpg
Extrazelluläre Signale führen dazu, dass das negativ geladene Phospholipid Phosphatidylserin (PS) von der Innenseite der Membran nach außen kommt. Die Protease ADAM17 kann in diesem Moment mit PS elektrostatisch interagieren und wird so in die Lage versetzt, Substrate (z.B. TNF-α) freizusetzen. Durch Freisetzung von TNF α werden Entzündungsreaktionen in unserem Körper entscheidend beeinflusst. Grafik: Dr. Anselm Sommer
Kontakt:
Prof. Dr. Karina Reiß
Klinik für Dermatologie, Venerologie und Allergologie
Tel.: 0431/597-4786
kreiss@dermatology.uni-kiel.de
Dr. Anselm Sommer
Klinik für Dermatologie, Venerologie und Allergologie
Tel.: 0431/597-1062
asommer@dermatology.uni-kiel.de
Exzellenzcluster Entzündungsforschung
Wissenschaftliche Geschäftsstelle, Leitung: Dr. habil. Susanne Holstein
Presse und Kommunikation, Sonja Petermann, Text: Kerstin Nees
Postanschrift: Christian-Albrechts-Platz 4, D-24118 Kiel
Telefon: (0431) 880-4850, Telefax: (0431) 880-4894
E-Mail: spetermann@uv.uni-kiel.de
Internet: www.inflammation-at-interfaces.de
Der Exzellenzcluster „Inflammation at Interfaces/Entzündungsforschung“ wird seit 2007 durch die Exzellenzinitiative des Bundes und der Länder mit einem Gesamtbudget von 68 Millionen Euro gefördert; derzeit befindet er sich in der zweiten Förderphase. Die rund 300 Clustermitglieder an den insgesamt vier Standorten: Kiel (Christian-Albrechts-Universität zu Kiel, Universitätsklinikum Schleswig-Holstein), Lübeck (Universität zu Lübeck, UKSH), Plön (Max-Planck-Institut für Evolutionsbiologie) und Borstel (Forschungszentrum Borstel – Leibniz-Zentrum für Medizin und Biowissenschaften) forschen in einem innovativen, systemischen Ansatz an dem Phänomen Entzündung, das alle Barriereorgane wie Darm, Lunge und Haut befallen kann.
http://inflammation-at-interfaces.de/de/newsroom/aktuelles/regulation-von-botens…
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…