Proteinstruktur des E. coli Bakteriums entschlüsselt

Mithilfe einer neuen Methodik der NMR-Spektroskopie ist es Wissenschaftlern erstmals gelungen, die dreidimensionale Struktur eines sehr großen Membranproteins des E. coli Bakteriums aufzuklären.
In der aktuellen Online-Ausgabe des Wissenschaftsmagazins Science vom 26. Juni veröffentlichen sie die Ergebnisse ihrer fast 10-jährigen Forschungs- und Entwicklungsarbeit.
Neben der technischen Verfeinerung der Methodik sind die Ergebnisse gleichzeitig von großer medizinischer Bedeutung in der Arzneimittelforschung. Sie bilden die Grundlage für die Entwicklung gezielt wirksamer Medikamente etwa in der Krebsforschung.
Die NMR-Spektroskopie (Nuclear Magnetic Resonance) ist eine weit verbreitete Analysemethode. In der Biochemie ermöglicht sie es, Proteine wie zum Beispiel die des E. coli Bakteriums nachzuweisen, sie im Detail zu analysieren und dreidimensional in Lösung darzustellen. Über die dreidimensionalen Strukturen erhalten die Wissenschaftler Auskunft über die Funktionsweise der Proteine.
Je größer ein Protein ist, desto problematischer ist seine Analyse. Besonders schwierig zu bestimmen sind darüber hinaus Proteine, die in Zellmembranen vorkommen. Unter den zurzeit rund 58.000 aufgeklärten Proteinstrukturen befinden sich bisher nur etwa 100-150 kleinere Membranproteine. Für das zelluläre Leben sind sie jedoch essentiell. Sie sind verantwortlich für den Transport von Nährstoffen und Signalen. Das heißt, sie kommunizieren mit der Umgebung. Daher sind sie für die Wissenschaft von großem Interesse.
Dr. Frank Sönnichsen vom Otto Diels-Institut für Organische Chemie der Christian-Albrechts-Universität (CAU) und seinen Kollegen ist es beim E. coli Bakterium gelungen, ein sehr großes Membranprotein zu entschlüsseln. Es besteht aus 360 Aminosäuren mit neun Helixen. E. coli ist ein säurebildendes Bakterium, das im menschlichen und tierischen Darm vorkommt.
„Die neue Methodik ist eine bedeutende und wichtige Erweiterung unseres technischen Arsenals“, sagt Sönnichsen, Co-Autor der neuen Science-Studie. „Mit ihr hoffen wir künftig auch die Eigenschaften großer menschlicher Proteine entschlüsseln zu können – etwa aus den Bereichen der Brustkrebs- oder Alzheimerforschung.“ Eine Kenntnis der dreidimensionalen Struktur sei vor allem für die Entwicklung neuer Heilmittel relevant.
Momentan binden sich etwa 60 Prozent aller Arzneimittel an Membranproteine. Jedoch sind erst wenige in ihrer genauen Struktur und Funktion erforscht: „Die Medikamente wirken zwar, doch wir wissen nicht immer, wie sie es tun“, so Sönnichsen. „Mit unserer neuen Methodik legen wir die Grundlage für die Wirkstoffforschung, gezielter wirkende Heilmittel zu entwickeln und so auch Nebenwirkungen zu reduzieren.“
An der Studie, die Charles R. Sanders, Professor für Biochemie an der Vanderbilt Universität in Nashville, USA, koordiniert hat, sind neun Autoren beteiligt. Neben den Kollegen aus den USA, Korea und China ist der Kieler Chemiker Sönnichsen einziger europäischer Vertreter.
Foto und Abbildung zum Thema stehen zum Download bereit:
http://www.uni-kiel.de/download/pm/2009/2009-062-1.jpg
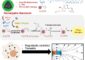
Bildunterschrift: Darstellung der räumlichen Struktur des E. coli Membranproteins mit gebundenem Substrat (Mitte) und Helixbändern.
Copyright: Frank Sönnichsen, Quelle: Science
http://www.uni-kiel.de/download/pm/2009/2009-062-2.jpg
Bildunterschrift: Laborarbeit: Dr. Frank Sönnichsen setzt ein Messröhrchen ins NMR-Spektrometer ein. Es misst die physikalischen Eigenschaften des Proteins, wie zum Beispiel die räumliche Struktur des E. coli Bakteriums
Copyright: CAU, Foto: Jürgen Haacks
Kontakt:
Dr. Frank Sönnichsen
Leiter der Spektroskopie
Otto Diels-Institut für Organische Chemie
Christian Albrechts Universität zu Kiel
Tel: 0431/880-2455
E-Mail: fsoennichsen@oc.uni-kiel.de
Media Contact
Weitere Informationen:
http://www.uni-kiel.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Merkmale des Untergrunds unter dem Thwaites-Gletscher enthüllt
Ein Forschungsteam hat felsige Berge und glattes Terrain unter dem Thwaites-Gletscher in der Westantarktis entdeckt – dem breiteste Gletscher der Erde, der halb so groß wie Deutschland und über 1000…

Wasserabweisende Fasern ohne PFAS
Endlich umweltfreundlich… Regenjacken, Badehosen oder Polsterstoffe: Textilien mit wasserabweisenden Eigenschaften benötigen eine chemische Imprägnierung. Fluor-haltige PFAS-Chemikalien sind zwar wirkungsvoll, schaden aber der Gesundheit und reichern sich in der Umwelt an….

Das massereichste stellare schwarze Loch unserer Galaxie entdeckt
Astronominnen und Astronomen haben das massereichste stellare schwarze Loch identifiziert, das bisher in der Milchstraßengalaxie entdeckt wurde. Entdeckt wurde das schwarze Loch in den Daten der Gaia-Mission der Europäischen Weltraumorganisation,…