Proteine lichten den Anker: Wie das Schalterprotein Rab aus der Membran gezogen werden
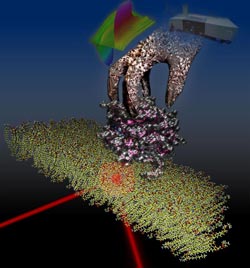
Wenn GDI zupackt: An einer Membranoberfläche sitzt das Rab-Protein (grau und magenta) mit gebundenem GDP (bunt). Der Infrarotstrahl wird von der Oberfläche reflektiert und erlaubt so, die an der Membran stattfindenden Vorgänge zu verfolgen. Das GDI, symbolisiert durch eine Hand, ergreift das Rab-Protein und zieht es aus der Membran. Der zeitliche Verlauf der Infrarotspektren (oben mittig) wird dabei im Spektrometer (oben rechts) aufgelöst.<br>Grafik: Konstantin Gavriljuk<br>
Forscher der Ruhr-Universität Bochum und vom MPI Dortmund haben erstmals den Recyclingvorgang von Proteinen, die den Zelltransport regulieren, in einem biophysikalischen Experiment nachgestellt. Dabei verfolgten sie im Detail, wie das zentrale Schalterprotein Rab aus der Lipidmembran herausgezogen wird.
Die spektroskopischen und dynamischen Daten berichtet das Team um PD Dr. Carsten Kötting, Prof. Dr. Klaus Gerwert (Lehrstuhl für Biophysik, RUB) und Prof. Dr. Roger S. Goody (Max-Planck-Institut für Molekulare Physiologie, Dortmund) in der Online Early Edition der Zeitschrift PNAS. „Zuvor sind Interaktionen dieses Proteins immer nur in Lösung, also ohne eine Lipidmembran untersucht worden. Der Schritt in die natürliche Umgebung des Proteins eröffnet ganz neue Möglichkeiten“, sagt Carsten Kötting. Denn viele krankheitsrelevante Proteininteraktionen finden in der Zelle an einer Membran statt.
Aus der Lösung an die Membran
Anders als Ras-Proteine, die das Zellwachstum regulieren, steuern Rab-GTPasen diverse Transportvorgänge zwischen verschiedenen Bereichen einer Zelle. Die Rab-GTPasen, auch Rab-Proteine genannt, funktionieren genau wie die Ras-Proteine als Schalter. Im „An“-Zustand ist das energiereiche Molekül GTP gebunden, im „Aus“-Zustand das energieärmere GDP. Das Schalterprotein Rab schwimmt nicht einfach mit seinem Transportgut durch die Zelle, sondern ist mit lipidähnlichen Ankern in der Membran befestigt. Nach erfolgtem Transport wird Rab aus der Membran herausgezogen und recycelt. Dieser Vorgang konnte bisher nicht im biophysikalischen Experiment nachgestellt werden. Dem Team aus Bochum und Dortmund ist es gelungen, das Rab-Protein mit dem Membrananker in seiner aktiven Form in großen Mengen herzustellen, an eine künstliche Lipidmembran zu binden und das Herausziehen des Schalterproteins aus der Membran spektroskopisch zu untersuchen.
Zupacken und festziehen
Dazu nutzten die Biophysiker die ATR-Infrarotspektroskopie; mit dieser Methode können sie Vorgänge an Oberflächen wie Lipidmembranen sichtbar machen. Sie schauten besonders auf das Protein GDI, welches das Rab-Protein und seinen Lipidanker bindet. Unklar war, ob Rab sich spontan von der Membran ablöst und GDI es dann abfängt oder ob GDI eine aktive Rolle beim Rab-Recycling einnimmt. Mit der ATR-Spektroskopie konnte das Team erstmals zwischen diesen Vorgängen unterscheiden und eine aktive Rolle für GDI nachweisen. „Wir haben gesehen, dass GDI zur Membran kommt und das Rab-Protein an Ort und Stelle packt“, erklärt Konstantin Gavriljuk. „Dann zieht GDI das Rab viel schneller aus der Membran, als es sich von allein ablösen würde.“
Legionellen greifen in zelluläre Transportprozesse ein
Rab-GTPasen und ihre Interaktionspartner spielen eine Rolle bei diversen Krankheiten, zum Beispiel einigen Formen von geistiger Behinderung oder auch der Legionärskrankheit. Die Erreger der Legionärskrankheit, die Legionellen, attackieren Rab-Proteine, modifizieren sie chemisch und greifen dadurch in zelluläre Transportprozesse ein; das ermöglicht es ihnen, sich in menschlichen Zellen zu vermehren. Die Experimente ergaben, dass die chemische Modifikation durch die Legionellen das Herausziehen von Rab aus der Membran durch GDI behindert. „Wir verstehen nun besser, an welcher Stelle Legionellen die Zelle angreifen und was die Auswirkungen davon sind“, sagt Carsten Kötting.
Projektförderung
Fördermittel für das Projekt stammen vom SFB 642 „GTP- und ATP-abhängige Membranprozesse“, dessen Sprecher Prof. Gerwert ist.
Titelaufnahme
K. Gavriljuk, A. Itzen, R.S. Goody, K. Gerwert, C. Kötting (2013): Membrane extraction of Rab proteins by GDP dissociation inhibitor characterized using attenuated total reflection infrared spectroscopy, PNAS, doi:10.1073/pnas.1307655110
Weitere Informationen
Prof. Dr. Klaus Gerwert, Lehrstuhl Biophysik, Fakultät für Biologie und Biotechnologie der Ruhr-Universität, 44780 Bochum, Tel. 0234/32-24461, E-Mail: klaus.gerwert@bph.rub.de
PD Dr. Carsten Kötting, Lehrstuhl Biophysik, Fakultät für Biologie und Biotechnologie der Ruhr-Universität, 44780 Bochum, Tel. 0234/32-24873, E-Mail: Koetting@bph.rub.de
Angeklickt
Frühere Presseinfo zu Rab
http://aktuell.ruhr-uni-bochum.de/pm2012/pm00416.html.de
Redaktion: Dr. Julia Weiler
Media Contact
Weitere Informationen:
http://www.ruhr-uni-bochum.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Merkmale des Untergrunds unter dem Thwaites-Gletscher enthüllt
Ein Forschungsteam hat felsige Berge und glattes Terrain unter dem Thwaites-Gletscher in der Westantarktis entdeckt – dem breiteste Gletscher der Erde, der halb so groß wie Deutschland und über 1000…

Wasserabweisende Fasern ohne PFAS
Endlich umweltfreundlich… Regenjacken, Badehosen oder Polsterstoffe: Textilien mit wasserabweisenden Eigenschaften benötigen eine chemische Imprägnierung. Fluor-haltige PFAS-Chemikalien sind zwar wirkungsvoll, schaden aber der Gesundheit und reichern sich in der Umwelt an….

Das massereichste stellare schwarze Loch unserer Galaxie entdeckt
Astronominnen und Astronomen haben das massereichste stellare schwarze Loch identifiziert, das bisher in der Milchstraßengalaxie entdeckt wurde. Entdeckt wurde das schwarze Loch in den Daten der Gaia-Mission der Europäischen Weltraumorganisation,…





















