Proteine bei der Arbeit beobachtet
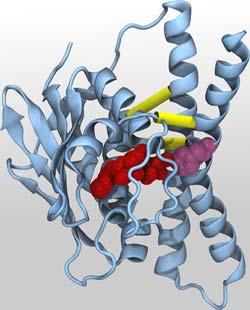
Aktivierte Anordung des Sensor-Histidinkinase-Proteins: In Blau ist das Protein dargestellt, in Gelb kritische Kontakte, in Rot Adenosintriphosphat, das in dieser Anordnung direkt mit einer bestimmten Aminosäure (dargestellt in Pink) wechselwirken kann. Abbildung: Dr. Alexander Schug<br>
Über Genomanalyse, Computersimulationen und Laborexperimente hat ein internationales Forscherteam erstmals ein Modell der aktivierten Sensor-Histidinkinase, eines Proteins zur Signalübertragung, erarbeitet. Dr. Alexander Schug vom Karlsruher Institut für Technologie (KIT) bildete die Aktivierung in umfangreichen Computersimulationen nach. In der Zeitschrift PNAS stellen die Forscher ihre Ergebnisse vor, die Methode lässt sich auch auf andere Proteine übertragen.
Proteine bilden die molekulare Maschinerie des Körpers und erfüllen die verschiedensten Aufgaben: Als Strukturproteine sind sie maßgeblich am Aufbau von Gewebe beteiligt. Als Funktionsproteine sind sie unter anderem für die Steuerung des Stoffwechsels, den Stofftransport, die Blutgerinnung und die Immunabwehr verantwortlich. Während Proteine ihre Funktion erfüllen, verändern sie häufig ihre Struktur. Diese aktivierte Struktur ist oft nur kurzlebig und daher experimentell schwer zugänglich. Um die Funktion eines Proteins zu verstehen und eventuell gezielt zu beeinflussen, etwa bei der Behandlung von Krankheiten mit Medikamenten, ist es jedoch erforderlich, die Strukturveränderungen genau zu kennen.
In einem Projekt, das Genomanalyse, Computersimulation und Experimente zur Erbgutveränderung verbindet, haben Forscher aus den USA, Frankreich und Deutschland ein Strukturmodell einer schwer fassbaren aktivierten Anordnung eines wichtigen Proteins erarbeitet. Die Computersimulation und Strukturnachbildung übernahm Dr. Alexander Schug, Leiter der Helmholtz Junior Research Group „Multiscale Biomolecular Simulation“ am Steinbuch Centre for Computing (SCC) des KIT. In der Zeitschrift PNAS stelllen die Forscher nun ihre Ergebnisse vor.
Die Wissenschaftler konzentrierten sich auf Zwei-Komponenten-Signalübertragungssysteme, die besonders in Bakterien sehr häufig sind. Solche Systeme bestehen aus einem Sensor-Histidinkinase-Protein als Empfänger für Signale von außen, das die Informationsübertragung durch eine sogenannte Autophosphorylierung einleitet, und einem Antwortregulator-Protein. Über diese Systeme lagen bisher nur teilweise Strukturinformationen vor.
Durch eine statistische Analyse einer großen Menge von Genomdaten identifierten die Forscher Teile des Sensor-Histidinkinase-Proteins, die während der Stukturveränderungen miteinander in Kontakt treten oder den Kontakt zueinander abbrechen. Basierend auf dieser Analyse, gelang es dem KIT-Forscher Dr. Alexander Schug, in umfangreichen Computersimulationen die Strukturveränderungen während der Autophosphorylierung nachzubilden und ein Modell der aktivierten Struktur zu erstellen. Dieses Modell ließ sich anschließend in Laborexperimenten verifizieren.
Zwei-Komponenten-Systeme stellen bei allen Bakterien das primäre Signal-Reaktions-System dar. Daher tragen die Ergebnisse der Forscher zum Verständnis der bakteriellen Signalübertragung bei. Die Erkenntnisse könnten künftig die Entwicklung neuer Antibiotika voranbringen. Überdies ist der Ansatz auch für andere Proteinsysteme relevant: „Da die reine Menge an Genomdaten in den vergangenen zehn Jahren geradezu explodiert ist und weiter rasant wächst, lässt sich unsere Methode auf immer mehr Proteine übertragen, auch über die Signalübertragung hinaus“, erklärt Schug.
Angel E. Dago, Alexander Schug, Andrea Procaccini, James A. Hoch, Martin Weigt, and Hendrik Szurmant: The Structural Basis of Histidine Kinase Autophosphorylation. Integrating Genomics, Molecular Dynamics and Mutagenesis. In: PNAS – Proceedings of the National Academy of Sciences of the United States of America. June 5, 2012 (DOI:10.1073/pnas.1201301109).
Die Online-Version des Artikels ist abrufbar unter: www.pnas.org/cgi/doi/10.1073/pnas.1201301109.
Das Karlsruher Institut für Technologie (KIT) ist eine Körperschaft des öffentlichen Rechts nach den Gesetzen des Landes Baden-Württemberg. Es nimmt sowohl die Mission einer Universität als auch die Mission eines nationalen Forschungszentrums in der Helmholtz-Gemeinschaft wahr. Das KIT verfolgt seine Aufgaben im Wissensdreieck Forschung – Lehre – Innovation.
Weiterer Kontakt:
Margarete Lehné
Presse, Kommunikation und
Marketing
Tel.: +49 721 608-48121
Fax: +49 721 608-43658
E-Mail: margarete.lehne@kit.edu
Media Contact
Weitere Informationen:
http://www.kit.eduAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















