Ein Protein gegen den grauen Star – Aktivierungsmechanismus eines Schutzproteins der Augenlinse aufgeklärt
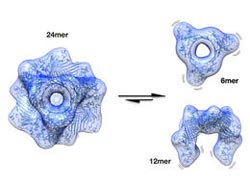
Speicherform (24mer) und aktive Formen des aB-Crystallin, die vor grauem Star schützen<br>
Schutzproteine sorgen dafür, dass diese Eiweiße, die nur ein einziges Mal angelegt werden, ein Leben lang nicht verklumpen. Versagt der Schutzmechanismus, trübt sich die Linse – der Patient bekommt grauen Star. Nun konnten Wissenschaftler der Technischen Universität München (TUM) entschlüsseln, wie eines der Schutzproteine aktiviert wird und so die Grundlage zur Entwicklung neuer Therapiemöglichkeiten legen.
Die Augenlinse des Menschen besteht aus einer hochkonzentrierten Proteinlösung, die ihr ihre hohe Brechkraft verleiht. Trotz dieses hohen Eiweißgehalts muss die Linse jedoch klar und lichtdurchlässig bleiben. Aus diesem Grund liegen hier einzigartige Bedingungen vor: Die Linsenzellen verzichten komplett auf die komplexe, in allen anderen Körperzellen vorhandene Maschinerie zum Auf- und Abbau von Proteinen. Stattdessen werden die Linsenproteine nur ein einziges Mal in der Embryonalentwicklung angelegt. Sie sind also so alt wie der Organismus selbst. Damit sie ein Menschenleben lang funktionieren, müssen die Eiweiße permanent in gelöstem Zustand gehalten werden. Verklumpen sie, führt das zu einer Trübung der Linse – grauer Star ist die Folge.
Alternative zur Operation
Bislang kann diese Erkrankung nur operativ, durch das Einsetzen einer künstlichen Linse, behandelt werden. Wäre jedoch der genaue Wirkmechanismus bekannt, der die Linsenproteine in ihrem gelösten Zustand erhält, könnte dies den Weg zu neuen Therapiemöglichkeiten eröffnen. Wie also schafft es die Zelle die Proteine so lange löslich zu halten? Verantwortlich hierfür sind zwei Schutzproteine, das sogenannte αA-Crystallin und sein Verwandter, das αB-Crystallin. Sie sind die bekanntesten Vertreter der Klasse der kleinen Hitzeschockproteine, die in vielen Körperzellen eine wesentliche Rolle spielen, denn sie bewahren andere Proteine davor, bei starker Hitze oder zellulärem Stress zu einem unbrauchbaren Knäuel zu verklumpen.
Wie diese Schutzproteine jedoch genau aussehen und wirken war trotz intensiver Forschung lange unbekannt. „Die große Herausforderung bei der Analyse der beiden Crystalline liegt in ihrer großen strukturellen Vielfalt“, erklärt Johannes Buchner, Professor für Biotechnologie der Technischen Universität München. „Es liegt ein Gemisch ganz verschiedener Formen vor, die sich aus unterschiedlich vielen Untereinheiten zusammensetzen. Dies macht es sehr schwer, die einzelnen Strukturen voneinander zu unterscheiden.“
Molekularer Schalter
In intensiver Zusammenarbeit mit Sevil Weinkauf, Professorin für Elektronenmikroskopie am Department Chemie, gelang es 2009, ein erstes Puzzleteil des großen Rätsels um das αB-Crystallin aufzudecken. Sie konnten die Molekularstruktur der wichtigsten Form des vielfältigen Proteins entschlüsseln – ein Komplex zusammengesetzt aus 24 identischen Untereinheiten. Dieser Komplex kommt unter normalen Bedingungen, das heißt wenn die Zelle keinem Stress ausgesetzt ist, am häufigsten vor. Er stellt jedoch eine Ruheform dar und verhindert das Verklumpen der anderen Proteine nur wenig – es musste also noch einen molekularen Schalter geben, der das Schutzprotein in Gang setzt.
Diesen Aktivierungsmechanismus konnten die Wissenschaftler um Buchner und Weinkauf nun entschlüsseln: Gerät die Zelle unter Stress, beispielsweise durch Einwirkung von Hitze, werden Phosphatgruppen an eine bestimmten Region des Proteins angeheftet. Die negativen Ladungen dieser Phosphate lösen dann die Verknüpfungen zwischen den Untereinheiten – der große Komplex zerfällt in kleinere, die nur noch aus sechs oder zwölf Untereinheiten bestehen. Durch diesen Zerfall werden die Regionen am einen Ende der neuen kleinen Komplexe flexibler und ermöglichen es dem Molekül nun an verschiedene Partner anzudocken und diese vor dem Verklumpen zu bewahren – das Schutzprotein ist aktiv.
Interdisziplinäre Kooperation
Zum Erfolg führte die Wissenschaftler vor allem die interdisziplinäre Kombination aus biochemischen und elektronenmikroskopischen Methoden. Die Information der zweidimensionalen elektronenmikroskopischen Bilder zu den vielfältigen dreidimensionalen Strukturen des αB-Crystallins wieder zusammen zu setzen gestaltete sich hierbei besonders schwierig. „Stellen Sie sich vor, Sie haben lediglich mehrere Bilder des Schattens einer Kaffeetasse zur Verfügung und möchten daraus auf die Tasse selbst schließen“, veranschaulicht Weinkauf den Sachverhalt. „Wenn Sie das als schwierig empfinden, stellen Sie sich nun vor, Sie hätten nicht nur einen Tassentyp sondern ein ganzes Service an Tassen, die Sie aus ihren Schattenbildern zusammensetzen müssen. Genau diese anspruchsvolle Aufgabe konnten wir beim αB-Crystallin lösen.“
Die neu gewonnenen Erkenntnisse zum Wirkmechanismus des αB-Crystallins bilden die Grundlage zu neuen Therapiemöglichkeiten. Zur Behandlung des grauen Stars wäre beispielsweise ein Medikament denkbar, das – eingespritzt in die Augenlinse – den Aktivierungsmechanismus des αB-Crystallins in Gang setzt und so die getrübte Linse wieder transparent werden lässt. Doch auch in anderen Gewebezellen spielt das αB-Crystallin eine Rolle. In Krebszellen etwa, ist das Protein zu aktiv und hindert die Zellen am programmierten Zelltod – hier würden neue Medikamente eher auf eine Hemmung des Proteins abzielen.
Die Forschungsarbeiten wurden unterstützt mit Mitteln des Exzellenzclusters Center for Integrated Protein Science Munich (CISPM) und des DFG Sonderforschungsbereichs 1035.
Originalpublikation:
Jirka Peschek, Nathalie Braun, Julia Rohrberg, Katrin Christiane Back, Thomas Kriehuber, Andreas Kastenmüller, Sevil Weinkauf and Johannes Buchner: Regulated structural transitions unleash the chaperone activity of αB-Crystallin, PNAS Early Edition, 2013
Kontakt:
Prof. Dr. Johannes Buchner
Technische Universität München
Fakultät für Chemie
Lichtenbergstraße 4, 85748 Garching, Germany
Tel.: +49 89 289 13340
Fax.: +49 89 289 13345
E-Mail: johannes.buchner@tum.de
Prof. Dr. Sevil Weinkauf
Tel.: +49 (89) 289 – 13517
Fax.: +49 (89) 289 – 13521
E-Mail: sevil.weinkauf@tum.de
Die Technische Universität München (TUM) ist mit rund 500 Professorinnen und Professoren, 10.000 Mitarbeiterinnen und Mitarbeitern und 35.000 Studierenden eine der forschungsstärksten Technischen Universitäten Europas. Ihre Schwerpunkte sind die Ingenieurwissenschaften, Naturwissenschaften, Lebenswissenschaften und Medizin, ergänzt um Wirtschafts- und Bildungswissenschaft. Die TUM handelt als unternehmerische Universität, die Talente fördert und Mehrwert für die Gesellschaft schafft. Dabei profitiert sie von starken Partnern in Wissenschaft und Wirtschaft. Weltweit ist sie mit einem Campus in Singapur sowie Niederlassungen in Brüssel, Kairo, Mumbai, Peking und São Paulo vertreten. An der TUM haben Nobelpreisträger und Erfinder wie Rudolf Diesel und Carl von Linde geforscht. 2006 und 2012 wurde sie als Exzellenzuniversität ausgezeichnet. In internationalen Rankings gehört sie regelmäßig zu den besten Universitäten Deutschlands.
Media Contact
Weitere Informationen:
http://www.tum.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…

Transparente emissive Mikrodisplays
… für ultraleichte und kompakte Augmented-Reality-Systeme. Im Rahmen des Projektes HOT („Hochperformante transparente und biegbare Mikro-Elektronik für photonische und optische Anwendungen“) haben Forschende des Fraunhofer-Instituts für Photonische Mikrosysteme IPMS ein…





















