Auf die Plätze, Phenylalanin los!
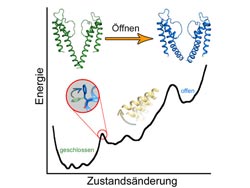
Schematische Darstellung des Öffnungs- und Schließmechanismus eines Ionenkanals<br>Copyright: Anna Stary-Weinzinger <br>
Ermöglicht wurde dies durch die Rechenleistung des Vienna Scientific Cluster (VSC), dem schnellsten Computer Österreichs. Ihre Erkenntnisse publizieren sie aktuell in der renommierten Fachzeitschrift PLOS Computational Biology.
Jede Zelle unseres Körpers grenzt sich von der Umgebung durch eine dünne Membran ab. Um ihre biologischen Funktionen aufrecht zu halten und Signale weiter zu leiten, gibt es in der Membran spezielle Proteine, so genannte Ionenkanäle. Anna Stary-Weinzinger und Tobias Linder von der Universität Wien sowie Bert de Groot vom Max Planck Institut für Biophysikalische Chemie in Göttingen fanden nun heraus, dass beim Öffnungs- und Schließmechanismus von Ionenkanälen der Aminosäure F114 (Phenylalanin) eine wichtige Schlüsselrolle zukommt. Sie dient gewissermaßen als Startsignal für die Öffnungsbewegung von Ionenkanälen.
„Diese Proteine sind hochselektiv für unterschiedliche Ionen wie Natrium, Kalium und Chlorid und ermöglichen je nach Bedarf eine enorme Durchflussrate von bis zu 100 Millionen Ionen pro Sekunde“, erklärt Stary-Weinzinger, Leiterin des Forschungsprojekts und Postdoc am Department für Pharmakologie und Toxikologie der Universität Wien. „Diese molekularen Schaltstellen steuern eine Vielzahl von lebenswichtigen Körperfunktionen wie die Weiterleitung von Nervenimpulsen, Regulierung unseres Herzrhythmus und Freisetzung von Neurotransmittern. Bereits leichte Funktionsstörungen der Kanäle, ausgelöst durch den Austausch einer einzigen Aminosäure, können zu schweren Erkrankungen wie Herzrhythmusstörungen, Migräne, Diabetes, bis hin zur Entstehung von Krebs führen.“
Neue Medikamente durch Verständnis der Funktionsweise von Ionenkanälen
Ionenkanäle sind wichtige Angriffspunkte zahlreicher Medikamente. Zehn Prozent der eingesetzten Arzneimittel erzielen ihre Wirkung durch Interaktion mit Ionenkanälen. Die Erforschung dieser Proteine hilft festzustellen, ob Medikamente im Körper an der richtigen Stelle wirken bzw. ob bessere Arzneistoffe entwickelt werden können. Als Grundlage der Medikamentenforschung ist zunächst allerdings ein genaues Verständnis der Funktionsweise der Kanäle unerlässlich, denn zur Regulation des Öffnungs- und Schließmechanismus sind noch viele Fragen offen.
Vienna Scientific Cluster zeigt Ionenkanäle in Aktion
Um diesen Proteinen auf atomarer Ebene bei der Arbeit – beim Öffnen und Schließen – zu sehen zu können, sind aufwändige Moleküldynamik-Simulationen am Computer erforderlich. Der für diese Analyse notwendige Rechenaufwand konnte mit Hilfe des Vienna Scientific Cluster (VSC), dem schnellsten Computer Österreichs, der von der Universität Wien, der Technischen Universität Wien und der Universität für Bodenkultur betrieben wird, geleistet werden. Mit Hilfe des VSC war erstmals möglich, für ein großes Protein (> 400 Aminosäuren) die Energielandschaft zwischen offenem und geschlossenem Zustand zu ermitteln. Dabei konnten die WissenschafterInnen zeigen, dass die zwei Zustände von zwei unterschiedlich großen Energiebarrieren getrennt werden.
Phenylalanin dient als Schalter für Zustandsänderungen des Kanals
Die Bewegung einer speziellen Aminosäure, des Phenylalaninrests 114, ist eng an die erste, kleinere Energiebarriere gekoppelt, so die überraschende Entdeckung der Forschungsgruppe. „Dieser Phenylalaninrest dient als Schalter, um den Ionenkanal aus dem geschlossenen Zustand zu entsichern“, erklärt Tobias Linder, Doktorand und Forschungsstipendiat der Universität Wien. Erst nach diesen lokal begrenzten Strukturveränderungen ist es dem Kanal möglich, in einer großen „globalen“ Bewegung die Pore vollständig zu öffnen. Dieser Übergang vom entsicherten Zwischenzustand zur vollständig geöffneten Pore ist mit einer zweiten, sehr viel größeren Energiebarriere verbunden.
Gefördert wurde diese Arbeit vom FWF-Doktoratskolleg „Molecular Drug Targets“ (MolTag), welches von Steffen Hering, Vorstand des Departments für Pharmakologie und Toxikologie der Fakultät für Lebenswissenschaften der Universität Wien, geleitet wird.
Publikation:
T. Linder, BL de Groot, A. Stary-Weinzinger: Probing the energy landscape of activation gating of the bacterial potassium channel KcsA. PLOS Computational Biology, Mai 2013.
DOI: 10.1371/journal.pcbi.1003058
Wissenschaftlicher Kontakt
Mag. Dr. Anna Stary-Weinzinger
Department für Pharmakologie und Toxikologie
Universität Wien
1090 Wien, Althanstraße 14 (UZA II)
T +43-1-4277-553 11
anna.stary@univie.ac.at
Rückfragehinweis
Mag. Veronika Schallhart
Pressebüro der Universität Wien
Forschung und Lehre
Universität Wien
1010 Wien, Universitätsring 1
T +43-1-4277-175 30
M +43-664-602 77-175 30
veronika.schallhart@univie.ac.at
Media Contact
Weitere Informationen:
http://www.univie.ac.atAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue Industrie-4.0-Lösung für niedrigschwelligen Zugang zu Datenräumen
»Energizing a Sustainable Industry« – das Motto der Hannover Messe 2024 zeigt klar, wie wichtig eine gleichermaßen leistungsstarke und nachhaltige Industrie für den Fertigungsstandort Deutschland ist. Auf der Weltleitmesse der…

Quantenpräzision: Eine neue Art von Widerstand
Physikforschende der Universität Würzburg haben eine Methode entwickelt, die die Leistung von Quantenwiderstands-Normalen verbessern kann. Sie basiert auf einem Quantenphänomen namens anomaler Quanten-Hall-Effekt. In der industriellen Produktion oder in der…

Sicherheitslücke in Browser-Schnittstelle erlaubt Rechnerzugriff über Grafikkarte
Forschende der TU Graz waren über die Browser-Schnittstelle WebGPU mit drei verschiedenen Seitenkanal-Angriffen auf Grafikkarten erfolgreich. Die Angriffe gingen schnell genug, um bei normalem Surfverhalten zu gelingen. Moderne Websites stellen…