Photopharmakologie – Lichtschranke für die Zellteilung
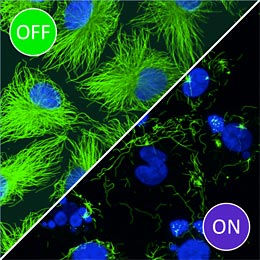
Mit Photostatinen behandelte Zellkulturen. Im Dunkeln (OFF) sind Mikrotubuli (grün) und Zellkerne (blau) intakt und als klar abgegrenzte Strukturen erkennbar. Durch die Beleuchtung mit Blaulicht (ON) werden die Mikrotubuli zerstört. Dadurch sterben die Zellen ab und die Zellkerne beginnen, sich zu zersetzen. Bild: Dirk Trauner / LMU
Zellen höherer Organismen sind von einem ausgeklügelten System röhrenförmiger Strukturen – sogenannter Mikrotubuli – durchzogen, die als Teil des Zellskeletts an vielen lebenswichtigen Prozessen beteiligt sind. Unter anderem sind die Mikrotubuli im zellulären Spindelapparat enthalten, der bei der Zellteilung die Chromosomen auf die Tochterzellen verteilt.
Wirkstoffe, die an den Mikrotubuli ansetzen, spielen daher sowohl für die Erforschung von Zellteilung und Embryonalentwicklung als auch als zellwachstum-hemmende Krebsmedikamente eine wichtige Rolle – verursachen aber oft starke Nebenwirkungen. Wissenschaftler um Professor Dirk Trauner und Dr. Oliver Thorn-Seshold vom Department Chemie der LMU haben nun einen entscheidenden Durchbruch geschafft, der zukünftig einen präziseren und schonenderen Einsatz derartiger Präparate ermöglichen soll:
„Wir haben in einen bekannten Mikrotubuli-Hemmer einen lichtsensitiven molekularen Schalter eingefügt, sodass der Wirkstoff nur nach Bestrahlung mit blauem Licht aktiv ist. Dadurch kann er erstmals gezielt nur am gewünschten Ort aktiviert – und auch wieder abgeschaltet werden, da die Reaktion reversibel ist“, sagt Thorn-Seshold. Trauner ergänzt: „Damit haben wir die Photopharmakologie auf eine weiteres hochdynamisches System angewandt, das allen Vielzellern gemeinsam ist: das Zytoskelett.“
In der Medizin gehören Wirkstoffe, die an den Mikrotubuli ansetzen, zu den wirkungsvollsten Chemotherapeutika. Allerdings entfalten diese Wirkstoffe ihre zellschädigende Wirkung im ganzen Körper, weshalb sie zu schweren Nebenwirkungen führen. „Unser Ziel war, einen Mikrotubuli-Hemmer so zu optimieren, dass er nur am gewünschten Einsatzort wirkt“, sagt Thorn-Seshold.
„Das haben wir erreicht, indem wir einen molekularen optischen Schalter für verschiedene chemische Abkömmlinge von Colchicin entwickelt haben“. Colchicin ist eine toxische chemische Verbindung, die aus der Herbstzeitlose stammt. Die mit optischem Schalter ausgestatteten Colchicin-Derivate bezeichnen die Wissenschaftler als Photostatine. Sie sind nur aktiv, wenn sie mit blauem Licht bestrahlt wurden, und können daher sehr präzise gesteuert werden – die Voraussetzung, um Tumorzellen gezielt und nebenwirkungsfrei zu bekämpfen.
Tumorzellen mit Licht stoppen
Im Zellversuch hat der Photoschalter seine Funktion bereits bewiesen: In mit blauem Licht bestrahlten Zellen hemmten Photostatine die Zellteilung 250-mal stärker als in Zellen, die im Dunkeln gehalten wurden. „Diese drastische licht-induzierte Aktivierung übersteigt alles, was bisher in der Photopharmakologie beobachtet wurde“, sagt Trauner.
„Möglich wurde sie, weil wir den optischen Schalter mit einer neuen Methode eingebaut haben, die eine besonders große Aktivitätssteigerung erlaubt“. Die Arbeit, an der neben Kollegen der Universität Lyon an der LMU auch die Arbeitsgruppen von Professor Angelika Vollmar und Professor Stefan Zahler sowie die Gruppe von PD Markus Rehberg beteiligt waren, ist in dem führenden Wissenschaftsjournal „Cell“ veröffentlicht worden.
Als mögliches zukünftiges Einsatzgebiet für Photostatine sehen die Wissenschaftler insbesondere örtlich begrenzte Tumore, die leicht mit einer Lichtquelle erreicht werden können, etwa Retinoblastome – die häufigsten Augentumore bei Kindern – oder Hautkrebs. „Lichtquellen werden heute schon in der Medizin häufig eingesetzt, etwa für Untersuchungen im Magen-Darm-Bereich. Da die LED-Technik derzeit eine rasante Entwicklung durchmacht, können wir uns auch vorstellen, dass es in Zukunft noch kleinere und hellere LEDs geben wird, die im Körper implantiert werden, etwa wie ein Herzschrittmacher“, sagt Thorn-Seshold. „Wir hoffen, dass sie sich dabei als vielversprechender Ansatz für die Entwicklung neuer Therapien bestätigen. Allerdings ist dies ein langwieriger Prozess, die Entwicklung und Durchführung der notwendigen Studien wird noch Jahre benötigen“.
Zellentwicklung im Sekundentakt schaltbar
Bereits jetzt sind die Photostatine aber auch ein vielversprechendes Werkzeug für die Zellbiologie: Mikrotubuli spielen als Bestandteil des Zellskeletts unter anderem bei der Zellteilung, dem intrazellulären Stofftransport und der Embryonalentwicklung eine essenzielle Rolle. Mit den Photostatinen können die Mikrotubuli erstmals räumlich und zeitlich sehr präzise gesteuert und wiederholt ein- und ausgeschaltet werden – und zwar innerhalb weniger als einer Sekunde.
Das schafft ganz neue Möglichkeiten, um die Funktion und räumliche Anordnung der Mikrotubuli zu erforschen. Gerade die Reversibilität der Hemmung ist in der Zellforschung ein besonderer Vorteil. „Wir konnten zum Beispiel die Entwicklung einer Zelle zu einem bestimmten Zeitpunkt anhalten und dann die Hemmung wieder ausschalten, um die Weiterentwicklung der Zelle zu beobachten. Dies könnte helfen, die Rolle bestimmter Vorläuferzellen während der Entwicklung aufzuklären“, erklärt Trauner.
Photopharmakologie ist noch ein relativ junges Forschungsgebiet, das zunehmend an Bedeutung gewinnen wird. In der Zukunft planen die Wissenschaftler, auch andere Moleküle, die an der Zellteilung und -dynamik beteiligt sind, mit Lichtschaltern auszustatten – die Mikrotubuli sind erst der Anfang.
(Cell 2015 Online am 9. Juli) göd
Publikation:
Photoswitchable inhibitors of microtubule dynamics optically control mitosis
and cell death
Malgorzata Borowiak, Wallis Nahaboo, Martin Reynders, Katharina Nekolla, Pierre Jalinot, Jens Hasserodt, Markus Rehberg, Marie DeLattre, Stefan Zahler, Angelika Vollmar, Dirk Trauner, Oliver Thorn-Seshold
Cell 2015
Doi:
http://dx.doi.org/10.1016/j.cell.2015.06.049
Kontakt:
Dirk Trauner
Professor of Chemical Biology
Department of Chemistry • University of Munich
Tel: +49 (0)89 2180-77800
Fax: +49 (0)89 2180-77972
Media Contact
Weitere Informationen:
http://www.uni-muenchen.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















