Optogenetik – fusionierte Ionenkanäle als Lichtschalter
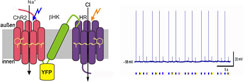
Molekularer Kombischalter: Zwei lichtempfindliche Membranproteine - hier rot und violett - sind über ein Zwischenstück (grün) in der Zellwand verankert (links). Blaues Licht lässt Natrium-Ionen, oranges Licht Chlorid-Ionen in die Zelle einströmen. Entsprechend wird die Zelle aktiviert oder deaktiviert (rechts). © Max-Planck-Institut für Biophysik <br>
Fliegen, die auf Knopfdruck balzen, Würmer, die ferngesteuert zappeln – seit Erfindung der Optogenetik können Wissenschaftler Nervenzellen per Lichtblitz ein- und ausschalten.
Ein Forscherteam des Max-Planck-Instituts für Biophysik in Frankfurt am Main hat nun einen molekularen Kombi-Lichtschalter entwickelt der es ermöglicht, Zellen noch präziser zu steuern als bisher. Der Schalter besteht aus zwei unterschiedlichen, lichtempfindlichen Membranproteinen, die als Ein- und Ausschalter dienen. Die Methode, mit der die Wissenschaftler die beiden Komponenten verknüpfen, eignet sich für unterschiedliche Proteinvarianten und ist deshalb vielseitig einsetzbar.
Ziel des noch jungen Forschungsgebiets der Optogenetik ist es, Zellen mithilfe von Licht zu kontrollieren. Dazu machen sich Forscher lichtempfindliche Proteine zunutze, die natürlicherweise in der Zellwand bestimmter Algen und Bakterien vorkommen. Um damit eine Nervenzelle zu steuern, schleusen sie Gene mit der Bauanleitung für solche Membranproteine ins Erbgut der Zelle ein. Je nachdem, welche Proteine die Wissenschaftler verwenden, können sie Zellen auf diese Weise mit Ein- und Ausschaltern ausstatten, die auf Licht unterschiedlicher Wellenlänge reagieren.
Für eine präzise Steuerung ist es dabei wichtig, dass sich die Zelle ebenso gut an- wie ausknipsen lässt. Genau hier lag bisher das Problem, denn werden die Gene separat eingeschleust, stellt die Zelle unterschiedlich viele Kopien der jeweiligen Proteine her. Dies führt dazu, dass ein Schaltertyp dominiert.
Eine Gruppe von Wissenschaftlern um Ernst Bamberg vom Max-Planck-Institut für Biophysik hat nun eine ebenso elegante wie vielseitige Lösung entwickelt: Die Forscher haben dazu die Gene für Ein- und Ausschaltprotein auf demselben Stück Erbsubstanz untergebracht, zusammen mit einem weiteren Gen, das die Montageanleitung für ein Verbindungsstück trägt. Dieses zwischengeschaltete Protein koppelt die Schalterproteine aneinander und verankert sie stabil in der Zellmembran. „Auf diese Weise können wir sicherstellen, dass Ein- und Ausschalter nebeneinander und immer im Verhältnis 1:1 in die Zellwand eingebaut werden. Das ermöglicht es uns, die Zelle präzise zu kontrollieren“, erklärt Ernst Bamberg.
Der Kombi-Lichtschalter, den die Forscher ausgetüftelt haben, besteht aus den beiden Membranproteinen Channelrhodopsin-2 und Halorhodopsin. Channelrhodopsin-2 stammt ursprünglich aus der einzelligen Grünalge Chlamydomonas reinhardtii. Das Protein reagiert auf blaues Licht, indem es die Zellwand für positiv geladene Ionen durchlässig macht. Durch den Ioneneinstrom wird ein Nervenimpuls ausgelöst, der die Zelle aktiviert. Halorhodopsin, das Wissenschaftler aus dem Bakterium Natromonas pharaonis isoliert haben, hat den gegenteiligen Effekt: Wird die Zelle mit orangem Licht bestrahlt, lässt es negativ geladene Ionen einströmen, was Nervenimpulse unterdrückt.
Da Channelrhodopsin-2 und Halorhodopsin auf Licht unterschiedlicher Wellenlänge reagieren, ist das Protein-Duo ein nützliches Werkzeug, um Zellen gezielt an- und auszuknipsen. Wie die Forscher gezeigt haben, eignet sich die Methode, mit der sie die beiden Moleküle verknüpfen, aber auch für andere Proteinvarianten: „Indem wir verschiedene Proteine je nach Bedarf miteinander koppeln, können wir Zellen in Zukunft wesentlich genauer steuern als bisher“, sagt Bamberg.
Ansprechpartner
Prof. Dr. Ernst Bamberg
Max-Planck-Institut für Biophysik, Frankfurt am Main
Telefon: +49 69 6303-2000
Fax: +49 69 6303-2002
E-Mail: secretary-bamberg@biophys.mpg.de
Originalveröffentlichung
Sonja Kleinlogel, Ulrich Terpitz, Barbara Legrum, Deniz Gökbuget, Edward S Boyden, Christian Bamann, Philip G Wood & Ernst Bamberg
A gene-fusion strategy for stoichiometric and co-localized expression of light-gated membrane proteins
Nature Methods, Vol. 8(12); DOI:10.1038/NMETH.1766
Media Contact
Weitere Informationen:
http://www.mpg.de/4737081/Optogenetik_KombischalterAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















