Neuer Mechanismus der Meiose entdeckt
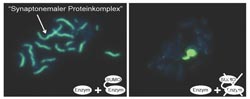
In Gegenwart des mit SUMO modifizierten Schritt-2-Enzyms bildet sich eine Proteinstruktur (Synaptonemaler Komplex) zwischen den homologen Chromosomen aus. Kann das Schritt-2-Enzym nicht mit SUMO modifiziert werden, fehlt der Komplex gänzlich. Martin Xaver, modifiziert von Andrea Pichler<br>
Eine wichtige Entdeckung in der Meioseforschung ist der Arbeitsgruppe um die Molekularbiologin Andrea Pichler vom Freiburger Max-Planck-Institut für Immunbiologie und Epigenetik gelungen. Die Wissenschaftlerin hat mit ihrer Forschergruppe einen neuen Mechanismus identifiziert, der eine entscheidende Rolle in der Meiose spielt.
Die Ausgangslage der Forschung
Die Meiose, auch Reduktionsteilung genannt, ist ein zentraler Vorgang der sexuellen Reproduktion. Dabei wird der Austausch des elterlichen Erbguts ermöglicht und die genetische Vielfalt gewährleistet.
Um verschiedene biologische Prozesse zu steuern, können Zellen gezielt die Eigenschaften ihrer Proteine verändern. Zum Beispiel deren Lebensdauer, Aktivität, den Reaktionspartner oder den Aufenthaltsort. Etwa indem sie ein oder mehrere kleine SUMO-Proteine anhängen. Dies geschieht in drei aufeinander folgenden enzymabhängigen Schritten. Beim Schritt-2-Enzym gingen Wissenschaftler davon aus, dass es sich um eine reine Durchgangsstation handelt.
Der Durchbruch
Wie die Freiburger Wissenschaftler nun herausfanden, wird das Schritt-2-Enzym selbst mit dem SUMO-Protein modifiziert und ändert dadurch seine Funktion. Der überraschende Effekt: Durch diese Änderung wird die herkömmliche Funktion des Enzyms ausgeschaltet, aber stattdessen eine neue hinzugewonnen. In Zusammenarbeit mit dem aktiven, unveränderten Enzym unterstützt es die Ausbildung von SUMO-Ketten. Wird dieser Effekt verhindert, hat dies gravierende Auswirkungen: Die Proteinstruktur (Synaptonemaler Komplex), die homologe Chromosomen in der Meiose miteinander verbindet, kann dann nicht mehr ausgebildet werden.
Die Erkenntnisse der Forscher
Geringste Mengen – weniger als ein Prozent – des SUMO modifizierten Schritt-2-Enzyms reichen aus, um eine normale Proteinstruktur wie auf dem linken Foto auszubilden. Forscherin Helene Klug aus dem Team um Pichler: „Kleinste Mengen des veränderten Enzyms genügen, um mit dem nicht modifizierten Enzym einen aktiven Komplex zu bilden, der dann die Meiose-abhängigen SUMO Modifikationen durchführt“.
„Anfangs widersprachen sich die Ergebnisse der biologischen und biochemischen Experimente komplett, obwohl die Daten absolut stichhaltig waren. Wir waren deshalb überzeugt, dass beide Beobachtungen richtig sind. Diesen Gegensatz zu erklären, hat uns dann zu dem neuen Mechanismus geführt“, so Studienleiterin Pichler. In aufwändigen biochemischen Experimenten konnten die Forscher außerdem erstmals enthüllen, wie dieser Enzymkomplex die Bildung von SUMO-Ketten ausführt.
Mit diesen neuen Erkenntnissen werden nach 50 Jahren Forschung um den Synaptonemalen Komplex die Weichen neu gestellt: „Erstmals können wir nun den Verlust des Synaptonemalen Komplexes nahezu nebenwirkungsfrei studieren und erhoffen uns, dessen Geheimnis auf die Spur zu kommen. Das erlaubt uns, die Konsequenzen für die Meiose und infolgedessen für die Keimzellentwicklung zu untersuchen“, sagen Franz Klein und Martin Xaver, Kooperationspartner und Meioseforscher der Max F. Perutz Laboratories, Wien.
Das Team um Pichler konnte bereits 2008 in Säugerzellen zeigen, dass die Selbst-Markierung des Schritt-2-Enzyms Einfluss darauf hat, welche Proteine überhaupt mit SUMO markiert werden. Um eine biologische Funktion für diese Regulationsform zu finden, wechselte das Forscherteam zu dem simpleren Organismus, der Bäckerhefe Saccharomyces cerevisiae. „Jetzt, wo wir wissen, wo wir suchen müssen, wollen wir auch wieder zurück ins Säugersystem, um die Rolle dieser Enzymregulation dort näher zu untersuchen“, sagt Pichler. „Außerdem wollen wir die Funktion des Hefe-Enzymkomplexes in der meiotischen Chromosomenstruktur besser verstehen.“
Am Max-Planck Institut für Immunbiologie und Epigenetik (MPI-IE) in Freiburg, das 1961 gegründet wurde, untersuchen Wissenschaftler, wie sich das Immunsystem im Laufe der Evolution entwickelt hat und wie es sich während des Lebens verändert. Im Jahr 2007 wurde der Schwerpunkt Epigenetik neu etabliert. Darin untersuchen Forscher die Vererbung von Eigenschaften, die nicht auf Veränderungen der DNA-Sequenz basieren.
Publikation:
Klug H, Xaver M, Chaugule V K, Koidl S, Mittler G, Klein F, and Pichler A: Ubc9 Sumoylation Controls SUMO Chain Formation and Meiotic Synapsis in Saccharomyces cerevisiae (2013). Molecular Cell, 2. Mai 2013 http://dx.doi.org/10.1016/j.molcel.2013.03.027
Kontakt:
Dr. Andrea Pichler
Max-Planck-Institut für Immunbiologie und Epigenetik
Stübeweg 51
79108 Freiburg
E-Mail pichler@ie-freiburg.mpg.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Nanofasern-befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…





















