Neue Erkenntnisse über Funktion der Blut-Hirn-Schranke bei der Entstehung der Alzheimer Krankheit
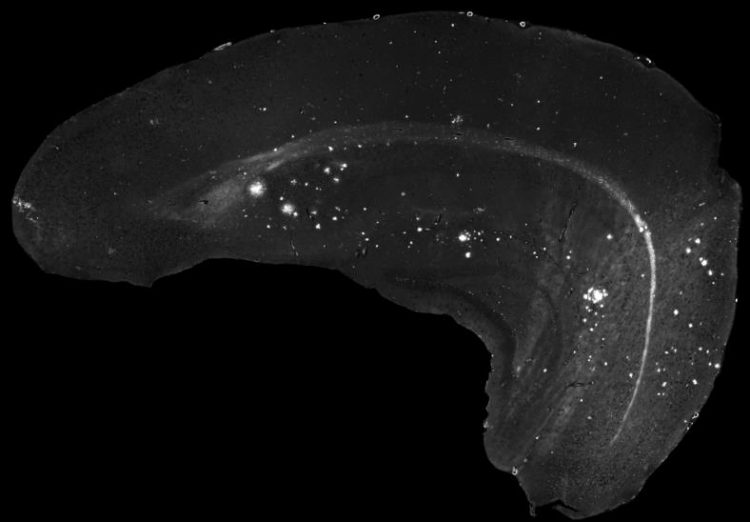
Ablagerungen des Amyloid-Beta-Proteins im Gehirn können markiert und mit einem Fluoreszenzmikroskop sichtbar gemacht werden.
Wissenschaftler des Instituts für Pathobiochemie der Universitätsmedizin Mainz haben neue Erkenntnisse über die Funktion der Blut-Hirn-Schranke bei der Entstehung der Alzheimer Krankheit gewonnen: Wenn die im Gehirn gebildeten Aβ-Peptide in Ermangelung eines geeigneten gerichteten Transports nicht aus dem Gehirn in die Blutbahn gelangen, dann aggregieren diese im Gehirn, werden toxisch und beeinträchtigen so die Lern- und Erinnerungsfähigkeit des Gehirns. Die Forschungsergebnisse wurden kürzlich in der renommierten Fachzeitschrift „Journal of Clinical Investigations“ veröffentlicht.
Die häufigste altersabhängige neurodegenerative Erkrankung ist die Alzheimer-Krankheit. Dabei sterben langsam fortschreitend Nervenzellen im Gehirn ab. Etwa 70 Prozent aller weltweit 46 Millionen und deutschlandweit 1,6 Millionen Demenzerkrankungen werden durch die Alzheimer-Krankheit hervorgerufen. Die Mehrzahl der Demenzkranken sind 60 Jahre und älter.
Da weltweit immer mehr alte Menschen leben, wird die Zahl der Erkrankungen weiter steigen. Die Betroffenen leiden zunehmend unter kognitiven Einschränkungen, die über den altersgemäßen Abbau der mentalen Fähigkeiten hinausgehen. Bislang gibt es für diese fortschreitende Hirnerkrankung weder eine Heilung, noch ist die Entstehung der Erkrankung vollständig verstanden.
Wissenschaftler des Instituts für Pathobiochemie der Universitätsmedizin Mainz haben nun neue Erkenntnisse über die molekulare und biochemische Funktion der Blut-Hirn-Schranke bei der Entstehung der Alzheimer Krankheit gewonnen: Wenn die im Gehirn gebildeten Aβ-Peptide in Ermangelung eines geeigneten gerichteten Transports nicht aus dem Gehirn in die Blutbahn gelangen, dann aggregieren diese im Gehirn, werden toxisch und beeinträchtigen so die Lern- und Erinnerungsfähigkeit des Gehirns. Die Forschungsergebnisse wurden kürzlich in der renommierten Fachzeitschrift „Journal of Clinical Investigations“ veröffentlicht.
Für die Alzheimer-Krankheit sind bisher nur symptomatische Therapieansätze verfügbar. Sie können das Fortschreiten der Erkrankung geringfügig verzögern, aber nicht den degenerativen Verlauf der Erkrankung beeinflussen. Die Forschung am Institut für Pathobiochemie der Universitätsmedizin Mainz soll dazu beitragen, neue Strategien zur Früherkennung und Prävention der Alzheimer Erkrankung zu entwickeln. Ihr Ansatzpunkt ist die sogenannte „Amyloidhypothese“. Grundlage dessen ist die Erkenntnis, dass lösliche Eiweißfragmente, sogenannte Aβ-Peptide, im Gehirn eine wichtige Rolle bei der Entstehung und dem Fortschreiten der Alzheimer Krankheit spielen.
Die Alzheimer-Krankheit zeichnet sich histopathologisch durch die Ablagerung von Amyloidpeptiden (Aβ) in unlöslichen Aggregaten (Plaques) im Hirngewebe der Patienten aus. Aβ-Peptide werden durch Spaltung eines zelleigenen Proteins, des Amyloid-Vorläuferproteins (APP), gebildet. Hierbei werden durch Enzyme Peptide unterschiedlicher Länge erzeugt. Laut der Amyloidhypothese ist eine Anhäufung der längeren Aβ42-Peptide im Gehirn ursächlich für den bei der Alzheimer Erkrankung beobachteten Verlust von Nervenzellen.
Bei der Frage, ob, in welcher Menge, wie und warum sich die längeren Peptide im Gehirn ansammeln, rückt die Blut-Hirn-Schranke in den wissenschaftlichen Fokus. Die Blut-Hirn-Schranke ist eine physiologische Barriere zwischen dem Blutkreislauf und dem Zentralnervensystem. Sie hat eine wesentliche Funktion bei der Aufrechterhaltung der Homöostase im Gehirn. Insbesondere dient sie dem Schutz des Gehirns, indem sie als natürliche Barriere den freien Übertritt von Substanzen in das Gehirn bzw. aus dem Gehirn in die Peripherie reguliert und das unkontrollierte Eindringen potentiell schädlicher Stoffe verhindert.
Aβ-Peptide können über die Blut-Hirn-Schranke entsorgt werden, diese Entsorgung nimmt aber mit fortschreitendem Alter ab. Wissenschaftler der Arbeitsgruppe „Molekulare Neurodegeneration“ am Institut für Pathobiochemie der Universitätsmedizin Mainz haben sich unter der Leitung von Univ.-Prof. Dr. Claus Pietrzik in einem aktuellen Forschungsprojekt der Frage gewidmet, was passiert, wenn der Abtransport aus dem Gehirn in die Blutbahn gestört ist.
Dazu entwickelten sie ein neues Tiermodell, das über eine spezifische Inaktivierung eines Transporters (LRP1) in den Endothelzellen der Blut-Hirn-Schranke verfügt. Mit Hilfe dieses Modellsystems, bei dem die im Gehirn gebildeten Aβ-Peptide nicht mehr im ausreichenden Maße in die Blutbahn gelangen, konnten die Forscher beobachten, dass sich der Anteil von löslichen – und damit giftigen – Aβ-Peptiden im Gehirn erhöhte. Zudem stellten sie fest, dass sich die Zunahme an toxischen Aβ-Peptiden im Gehirn negativ auf die kognitiven Leistungen wie beispielsweise die Lern- und Erinnerungsfähigkeit des Tiermodells auswirkte.
Diese Ergebnisse wurden von Steffen Storck aus dem Labor von Professor Pietrzik in einer Veröffentlichung des „Journal of Clinical Investigantions“ vorgestellt. Sie geben wichtige Hinweise auf die Bedeutung der Blut-Hirn-Schranke in der Pathologie der Alzheimer-Krankheit.
Originalpublikation: Storck SE, Meister S, Nahrath J, Meißner JN, Schubert N, Di Spiezio A, Baches S, Vandenbroucke RE, Bouter Y, Prikulis I, Korth C, Weggen S, Heimann A, Schwaninger M, Bayer TA, Pietrzik CU. 2015: Endothelial LRP1 transports amyloid-β1-42 across the blood-brain barrier. J Clin Invest. 2015 Nov 30. pii: 81108. doi: 10.1172/JCI81108. [Epub ahead of print]
Kontakt
Steffen Storck, Institut für Pathobiochemie, Universitätsmedizin der Johannes Gutenberg-Universität Mainz, Duesbergweg 6, 55128 Mainz, Telefon 06131 39-26692, Fax 06131 3926488, E-Mail: storck@uni-mainz.de
Prof. Dr. Claus Pietrzik, Institut für Pathobiochemie, Molekulare Neurodegeneration, Universitätsmedizin der Johannes Gutenberg-Universität Mainz, Duesbergweg 6, 55128 Mainz, Tel.: 06131 3925390, Fax: 06131 3926488, E-Mail: pietrzik@uni-mainz.de
http://www.unimedizin-mainz.de/pathobiochemie
Pressekontakt
Barbara Reinke, Stabsstelle Kommunikation und Presse Universitätsmedizin Mainz,
Telefon 06131 17-7428, Fax 06131 17-3496, E-Mail: pr@unimedizin-mainz.de
Über die Universitätsmedizin der Johannes Gutenberg-Universität Mainz
Die Universitätsmedizin der Johannes Gutenberg-Universität Mainz ist die einzige medizinische Einrichtung der Supramaximalversorgung in Rheinland-Pfalz und ein international anerkannter Wissenschaftsstandort. Sie umfasst mehr als 60 Kliniken, Institute und Abteilungen, die fächerübergreifend zusammenarbeiten. Hochspezialisierte Patientenversorgung, Forschung und Lehre bilden in der Universitätsmedizin Mainz eine untrennbare Einheit. Rund 3.300 Studierende der Medizin und Zahnmedizin werden in Mainz ausgebildet. Mit rund 7.500 Mitarbeiterinnen und Mitarbeitern ist die Universitätsmedizin zudem einer der größten Arbeitgeber der Region und ein wichtiger Wachstums- und Innovationsmotor.
Weitere Informationen im Internet unter www.unimedizin-mainz.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















