Neue Einblicke in Funktionsweise wichtiger Arzneimittelrezeptoren
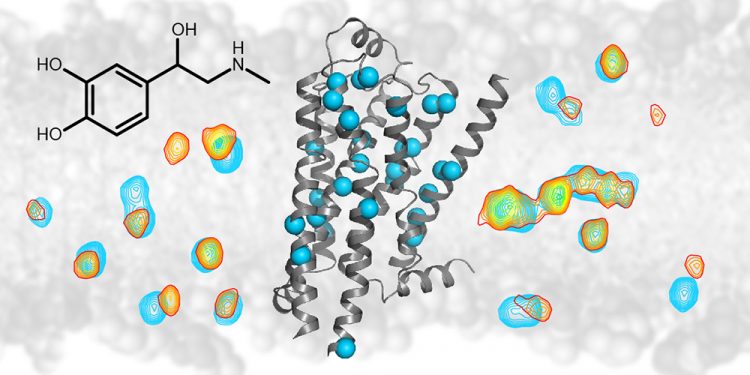
Durch NMR-Spektroskopie können Signale (gezeigt als Höhenlinien) von einzelnen Atomen (blaue Kugeln) des β1-Adrenorezeptors (graue Struktur) sichtbar gemacht werden. Bei der Bindung von Wirkstoffen wie Adrenalin (schwarze chemische Struktur) ändert sich das Signal der Atome (blau zu gelb/rot). Diese Änderung zeigt, wie sich der Effekt des Wirkstoffes durch die ganze Rezeptorstruktur ausbreitet. © Universität Basel, Biozentrum
Eine Vielzahl von Medikamenten wie Betablocker gegen Bluthochdruck oder Arzneistoffe zur Behandlung von Allergien, Krebs, Parkinson oder HIV binden an Proteine auf der Zelloberfläche, die zur Familie der G-Protein-gekoppelten-Rezeptoren gehören. Bindet ein Arzneistoff an einen solchen Rezeptor, so leitet dieser ein Signal ins Zellinnere weiter. Obwohl bereits zahlreiche Strukturen dieser Rezeptoren bekannt sind, war bis jetzt nicht klar, wie die Signale ins Innere einer Zelle übertragen werden.
Um die Art und Weise der Signalübertragung besser zu verstehen, hat das Team von Prof. Stephan Grzesiek am Biozentrum der Universität Basel nun gemeinsam mit Forschern des Paul-Scherrer-Instituts einen bestimmten Rezeptor – den sogenannten β1-Adrenorezeptor – genauer untersucht. Mithilfe der Kernmagnetresonanzspektroskopie (NMR) konnten sie verfolgen, wie die Struktur des Rezeptors auf verschiedene Wirkstoffe reagiert und erhielten damit ganz neue, detaillierte Einblicke in die Funktionsweise der gesamten Familie der G-Protein-gekoppelter-Rezeptoren.
Strukturänderungen geben Details über Rezeptorfunktion preis
Der β1-Adrenorezeptor ist ein Protein, das in der Membran von Herzzellen zu finden ist. Es fungiert als Übersetzer, denn durch das Andocken von Molekülen an der Zelloberfläche des Rezeptors werden Proteine im Zellinneren aktiviert. So löst zum Beispiel das Hormon Noradrenalin eine Signalkaskade aus, die schliesslich zum Anstieg der Herzfrequenz und des Blutdrucks führt. Betablocker wirken dem entgegen, indem sie das Hormon daran hindern, an den β1-Adrenorezeptor anzudocken. Genaue Details, wie die Bindung von Molekülen an den Rezeptor dessen Struktur verändert und so die Signalübertragung moduliert, waren bislang jedoch unklar.
«Wir haben mittels hochauflösender NMR-Spektroskopie die strukturellen Veränderungen des β1-Adrenorezeptor nach Bindung verschiedener Wirkstoffen analysiert», erklärt Shin Isogai, Erstautor der Studie. «So konnten wir beobachten, wie der Rezeptor seinen Bindungspartner erkennt, dessen chemische Struktur interpretiert und durch die Änderung seiner eigenen Struktur diese Information anschliessend ins Zellinnere weiterleitet. Diese Erkenntnisse über die Funktionsweise des β1-Adrenorezeptors lassen sich auf die ganze Familie der pharmakologisch bedeutsamen G-Protein-gekoppelten-Rezeptoren übertragen.»
Wirksamkeit von Arzneistoffen lässt sich vorhersagen
Durch die NMR-Analyse der Signale aus den Atomkernen konnten die Forscher feststellen, wie tief ein Wirkstoff in den Rezeptor eindringt, dabei einzelne Proteinteile beiseite schiebt, und wie dieses mechanische Signal ins Zellinnere übertragen wird. Dadurch konnten wichtige mechanische Verknüpfungen innerhalb der Rezeptorstruktur identifiziert werden, die für die Signalübertragung eine Rolle spielen. Die NMR-Daten geben auch ein direktes Mass für die Bindungsstärke der verschiedenen Wirkstoffe und für ihr Potenzial in der Zelle eine Antwort auszulösen.
Es war sogar möglich, eine solche Antwort direkt beim Binden eines intrazellulären Signalproteins an den aktivierten Rezeptor zu verfolgen. «Da diese Rezeptoren extrem schwierig zu untersuchen sind, freut es uns umso mehr, dass wir nun erstmals solche Einzelheiten aufdecken konnten. Viele Wissenschaftler treibt das schon mehr als ein Jahrzehnt um», betont Isogai. «Wir werden die Technik nun zur Erforschung der Rolle einzelner Aminosäuren in der Signalübertragung sowie anderer Rezeptoren verwenden.» Zukünftig könnte die NMR-Methode auch bei der Entwicklung und Testen neuer Arzneimittel zum Einsatz kommen.
Originalartikel:
Shin Isogai, Xavier Deupi, Christian Opitz, Franziska M. Heydenreich, Florian Brueckner, Gebhard F.X. Schertler, Dmitry B. Veprintsev and Stephan Grzesiek. Backbone NMR reveals allosteric signal transduction networks in the β1-adrenergic receptor. Nature 2016 |doi: 10.1038/nature16577
Weitere Auskünfte
Stephan Grzesiek, Universität Basel, Biozentrum, Tel.+41 61 267 21 00, E-Mail: stephan.grzesiek@unibas.ch
Media Contact
Weitere Informationen:
http://www.unibas.chAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Anlagenkonzepte für die Fertigung von Bipolarplatten, MEAs und Drucktanks
Grüner Wasserstoff zählt zu den Energieträgern der Zukunft. Um ihn in großen Mengen zu erzeugen, zu speichern und wieder in elektrische Energie zu wandeln, bedarf es effizienter und skalierbarer Fertigungsprozesse…

Ausfallsichere Dehnungssensoren ohne Stromverbrauch
Um die Sicherheit von Brücken, Kränen, Pipelines, Windrädern und vielem mehr zu überwachen, werden Dehnungssensoren benötigt. Eine grundlegend neue Technologie dafür haben Wissenschaftlerinnen und Wissenschaftler aus Bochum und Paderborn entwickelt….

Dauerlastfähige Wechselrichter
… ermöglichen deutliche Leistungssteigerung elektrischer Antriebe. Überhitzende Komponenten limitieren die Leistungsfähigkeit von Antriebssträngen bei Elektrofahrzeugen erheblich. Wechselrichtern fällt dabei eine große thermische Last zu, weshalb sie unter hohem Energieaufwand aktiv…





















