Medikament gegen Malaria verbessern
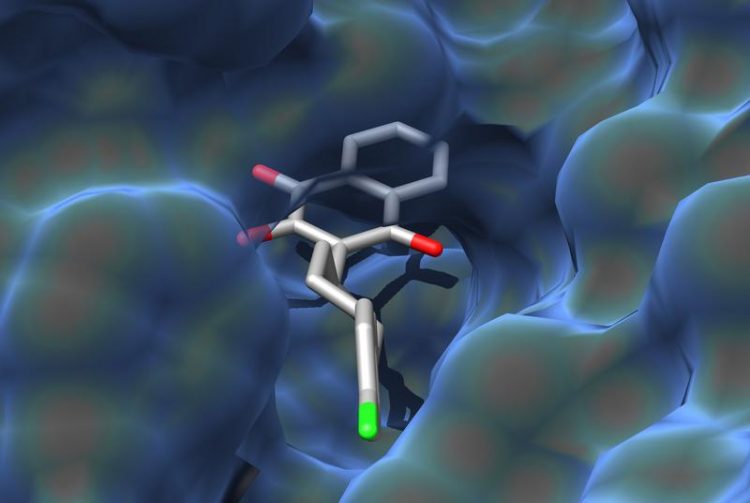
Wirkstoffmolekül in der Tasche: Die Darstellung zeigt, wie Atovaquon an sein Zielprotein bindet. Grafik: Dominic Birth, Carola Hunte
Die Arbeitsgruppe um Prof. Dr. Carola Hunte hat die Bindung des Antimalariamittels Atovaquon an sein Zielprotein beschrieben, indem sie die dreidimensionale Struktur des Protein-Wirkstoff-Komplexes mit dem Verfahren der Röntgenkristallographie bestimmt hat.
Der Kombinationswirkstoff Atovaquon-Proguanil ist Bestandteil des Medikaments Malarone®, das weltweit zur Prophylaxe und Behandlung von Malaria eingesetzt wird. Die Daten und die aus ihnen gewonnenen Erkenntnisse zur Wirkungsweise von Atovaquon können künftig dazu dienen, Medikamente gegen die Tropenkrankheit zu verbessern.
Hunte forscht mit ihrem Team am Institut für Biochemie und Molekularbiologie der Medizinischen Fakultät und am Exzellenzcluster BIOSS Centre for Biological Signalling Studies der Universität Freiburg. Die Wissenschaftlerinnen und Wissenschaftler haben ihre Ergebnisse in der Fachzeitschrift „Nature Communications“ veröffentlicht.
Malaria ist eine der weltweit gefährlichsten Tropenkrankheiten. Anopheles-Mücken, die mit Plasmodien – einer einzelligen Parasitenart – infiziert sind, übertragen die Krankheit durch ihren Stich. Atovaquon blockiert ein Protein der Atmungskette in den Mitochondrien, den Zellkraftwerken der Plasmodien, wodurch die Parasiten absterben.
Immer häufiger jedoch sind Stämme der Erreger aufgrund von Mutationen gegen den Wirkstoff resistent. Die Freiburger Wissenschaftler schufen nun die Basis, um mit verbesserten Medikamenten auf Resistenzen zu reagieren, indem sie den exakten Bindungsmodus von Atovaquon an das Zielprotein aufdeckten. Für ihre Analysen verwendeten sie den mitochondrialen Komplex aus Zellen der Bäckerhefe, der dem parasitären Komplex stark ähnelt.
Das Zielprotein von Atovaquon ist das dritte von vier Enzymen der Atmungskette im Mitochondrium. Mit seinen Aminosäurefäden bildet es eine dreidimensionale Tasche, in die das Wirkstoffmolekül mit seiner Form exakt hineinpasst, indem es an vielen Stellen an die Aminosäuren anbindet.
Diese Interaktionen sind entscheidend für die Wirkung, die Atovaquon in Plasmodien hervorruft und letztlich zum Absterben der Erreger führt. Mit einer Proteinsequenzanalyse zeigten die Forscherinnen und Forscher, dass ein Großteil dieser Andockstellen bei Plasmodien, der Bäckerhefe und in menschlichen Zellen gleich aufgebaut ist.
Im offenen Bereich der Bindungstasche geht Atovaquon einige Bindungen ein, die für Plasmodien spezifisch sind. Außerdem werden bei der Strukturanalyse die molekularen Ursachen von Resistenzen deutlich: Der Wirkstoff kann aufgrund von Mutationen, die den Aufbau des Zielproteins verändern, nicht wie vorgesehen andocken – er passt nicht mehr genau in die Tasche.
Die Daten liefern wichtige Grundlagen, um Antimalaria-Medikamente zu verbessern. Durch strukturbasiertes Wirkstoffdesign könnten Wissenschaftler die molekulare Struktur von Atovaquon gezielt verändern, sodass der Wirkstoff erforderliche Bindungen eingeht – und der Krankheitserreger nicht länger gegen ihn resistent ist.
Kontakt:
Prof. Dr. Carola Hunte
Institut für Biochemie und Molekularbiologie / BIOSS Centre for Biological Signalling Studies
Albert-Ludwigs-Universität Freiburg
Tel.: 0761/203-5279
E-Mail: carola.hunte@biochemie.uni-freiburg.de
http://www.pr.uni-freiburg.de/pm/2014/pm.2014-06-05.49-en?set_language=en
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Erstmals 6G-Mobilfunk in Alpen getestet
Forschende der Universität Stuttgart erzielen leistungsstärkste Verbindung. Notrufe selbst in entlegenen Gegenden absetzen und dabei hohe Datenmengen in Echtzeit übertragen? Das soll möglich werden mit der sechsten Mobilfunkgeneration – kurz…

Neues Sensornetzwerk registriert ungewöhnliches Schwarmbeben im Vogtland
Das soeben fertig installierte Überwachungsnetz aus seismischen Sensoren in Bohrlöchern zeichnete Tausende Erdbebensignale auf – ein einzigartiger Datensatz zur Erforschung der Ursache von Schwarmbeben. Seit dem 20. März registriert ein…

Bestandsmanagement optimieren
Crateflow ermöglicht präzise KI-basierte Nachfrageprognosen. Eine zentrale Herausforderung für Unternehmen liegt darin, Über- und Unterbestände zu kontrollieren und Lieferketten störungsresistent zu gestalten. Dabei helfen Nachfrage-Prognosen, die Faktoren wie Lagerbestände, Bestellmengen,…





















