Lichtsammler an Ort und Stelle bringen: Wie Photosyntheseproteine in die Membran gelangen
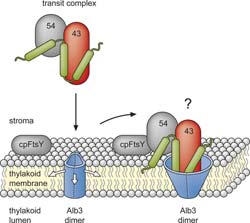
Neues Transportmodell: Proteine der Lichtsammelkomplexe (grün) müssen in spezielle Membranen im Inneren der Chloroplasten eingebaut werden (Thylakoidmembranen). Lösliche Proteine (43, 54) transportieren sie dorthin. Das Membranprotein Alb3 bildet durch Interaktion mit einem der löslichen Proteine (43) eine Pore, über die die Lichtsammelkomplexproteine in die Membran inseriert werden (Abbildung veröffentlicht im Journal of Biological Chemistry) Grafik: The American Society for Biochemistry and Molecular Biology<br>
Wie die zur Photosynthese notwendigen Lichtsammelkomplexe an ihren Wirkort in der Pflanzenzelle gelangen, berichten Biologinnen und Biologen der RUB im Journal of Biological Chemistry.
Das Team um Prof. Dr. Danja Schünemann (RUB-Arbeitsgruppe Molekularbiologie pflanzlicher Organellen) zeigte erstmals, dass ein Membranprotein mit nur einem einzigen löslichen Protein interagiert, um die Bausteine der Lichtsammelkomplexe in der Membran zu verankern. Die Forscher schlagen ein neues Modell vor, das die Integration in die Membran durch die Bildung einer Pore erklärt.
Licht sammeln
Photosynthese findet in speziellen Bereichen der Pflanzenzellen, den Chloroplasten statt, wobei der energieumwandelnde Prozess in bestimmten Proteinkomplexen (Photosystemen) erfolgt. Um die Lichtenergie einzufangen und effizient zu den Photosystemen zu leiten, sind Lichtsammelkomplexe erforderlich, die wie Antennen arbeiten. „Die Proteine der Lichtsammelkomplexe sind die am häufigsten vorkommenden Membranproteine auf der Erde“, so Dr. Beatrix Dünschede von der RUB. „Es gibt einen speziellen Transportmechanismus, der sie in die Chloroplasten befördert und dort in die Membran einbaut.“ Wie genau die verschiedenen Transportproteine miteinander interagieren, war bislang unklar.
Interaktion zwischen nur zwei Proteinen
Am Transport beteiligt sind mehrere lösliche Proteine und das Membranprotein Alb3, das die Proteine der Lichtsammelkomplexe in die Membran einschleust. Die Bochumer Biologen untersuchten intakte, isolierte Pflanzenzellen und fanden heraus, dass Alb3 zu diesem Zweck mit nur einem einzigen löslichen Transportprotein (cpSRP43) interagiert. Dieses Ergebnis bestätigten sie in einem zweiten Experiment mit künstlichen Membransystemen. „In einem weiteren Versuch haben wir die Stelle in Alb3 identifiziert, an die sich das lösliche Protein cpSRP43 bindet“, erklärt RUB-Biologe Dr. Thomas Bals. „Dabei stellte sich heraus, dass die Bindestelle teilweise innerhalb der Membran liegt und für cpSRP43 eigentlich nicht zugänglich sein kann.“
Durch die Pore in die Membran
Schünemanns Team erklärt die Daten mit einem neuen Modell. Die löslichen Transportproteine binden die Proteine der Lichtsammelkomplexe und befördern sie zur Membran. Dort interagiert das lösliche Transportprotein cpSRP43 mit dem Membranprotein Alb3, das daraufhin eine Pore bildet. Die Proteine der Lichtsammelkomplexe gelangen in die Pore und werden von dort seitlich in die Membran entlassen. „Es gibt Proteine in anderen Organismen, die Alb3 sehr ähnlich sind und scheinbar auch Poren bilden“, sagt Dünschede. „Das unterstützt unser Modell. Wir planen jetzt neue Versuche, um den gesamten Transportweg in einem künstlichen System nachzustellen.“
Titelaufnahme
B. Dünschede, T. Bals, S. Funke, D. Schünemann (2011) Interaction studies between the chloroplast signal recognition particle subunit cpSRP43 and the full-length translocase Alb3 reveal a membrane-embedded binding region in Alb3, Journal of Biological Chemistry, 286, 35187-35195, doi: 10.1074/jbc.M111.250746
Weitere Informationen
AG Molekularbiologie pflanzlicher Organellen, Fakultät für Biologie und Biotechnologie der Ruhr-Universität, 44780 Bochum
Dr. Beatrix Dünschede, Tel. 0234/32-28467, beatrix.duenschede@rub.de
Dr. Thomas Bals, Tel. 0234/32-28467, thomas.bals@rub.de
Prof. Dr. Danja Schünemann, Tel. 0234/32-24293, danja.schuenemann@rub.de
Angeklickt
Homepage der Arbeitsgruppe:
http://homepage.ruhr-uni-bochum.de/Danja.Schuenemann/Seiten_dt/index.html
Redaktion: Dr. Julia Weiler
Media Contact
Weitere Informationen:
http://homepage.ruhr-uni-bochum.de/Danja.Schuenemann/Seiten_dt/index.htmlAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















