Wie kommt der Zucker in die Zelle?
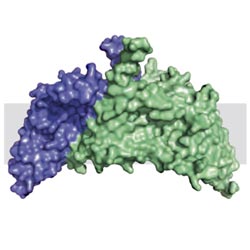
Die Struktur des ChbC-Dimers in der Zellmembran (graue Fläche) Bild: Columbia University<br>
Membranproteine spielen in allen Organismen eine wesentliche Rolle. Sie sind essentiell für die Kommunikation der Zelle mit ihrer Umgebung und sorgen für den Transport wichtiger Stoffe über die Zellmembran. Ihre besonderen Eigenschaften machen diese Proteine zum geeigeneten Ansatzpunkt für Medikamente.
Auf der Grundlage eines neuen bioinformatischen Ansatzes gelang es nun Wissenschaftlern der Columbia University, New York, und der Technischen Universität München (TUM) die Struktur eines wichtigen Zuckertransporters aufzuklären. Über ihre Ergebnisse berichtet die aktuelle Online-Ausgabe des Journals Nature.
Im Rahmen einer groß angelegten Kooperation ist es Wissenschaftlern der Columbia Universität gelungen, die dreidimensionale Struktur des bakteriellen Membranproteins ChbC mittels Kristallstrukturanalyse zu bestimmen. Die Proteinfamilie, zu der ChbC gehört, ist essentiell für den Transport spezifischer Zucker in die Zelle und stellt damit einen wesentlichen Faktor für das Überleben des Bakteriums dar. Wie diese Proteine jedoch den Zucker in die Zelle schleusen, war bisher nicht bekannt.
Möglich machten dieses Ergebnis Vorarbeiten des New York Consortium on Membrane Protein Structure (NYCOMPS). Im besonderen Fokus der Wissenschaftler stehen Membranproteine. „Jedes vierte Protein ist ein Membranprotein und doch kennen wir nur von etwa fünf Prozent von ihnen die Struktur. Hier stehen wir noch vor einer großen Herausforderung“, so Burkard Rost. Da die experimentelle Analyse eines Membranproteins mehrere Jahre dauern kann, kommt der Auswahl vielversprechender Kandidaten für die aufwändige Analyse eine große Bedeutung zu., Der Pool potentiell interessanter Sequenzen ist groß. Über 300.000 Proteinsequenzen aus den Genomen von 96 Organismen standen zu Beginn des Projektes zur Auswahl. Nur ein Bruchteil dieser Sequenzen kann jedoch überhaupt experimentell analysiert werden.
Gemeinsam mit anderen NYCOMPS-Bioinformatikern identifizierte Burkhard Rost, Professor für Bioinformatik an der TU München, ChbC als lohnendes Ziel. Ausgangspunkt der NYCOMPS-Wissenschaftler ist eine bioinformatische Methode aus dem Gebiet der „Strukturgenomik“ (engl. „Structural Genomics“). Die grundlegende Annahme dieser Methode ist, dass Proteine mit gemeinsamen evolutionären Vorfahren, sogenannte „Proteinfamilien“, sich sowohl in ihren Aminosäuresequenzen als auch in ihrer dreidimensionalen Struktur gleichen. Ist die Struktur eines dieser verwandten Proteine durch Experimente bekannt, lassen sich auch die restlichen vorhersagen.
Um ein geeignetes Protein zu finden, entwickelten die NYCOMPS-Wissenschaftler einen gängigen bioinformatischen Ansatz weiter. Statt wie üblicherweise zu Beginn des Projekts alle Proteine in einer Genom-übergreifenden Karte anzuordnen und dann eine Auswahl zu treffen, bauten die Bioinformatiker die Proteinfamilien jeweils um eine einzelne Sequenz herum auf. Der Vorteil eines solchen „Kernproteins“ („seed protein“) ist, dass die Wissenschaftler interessante Zielsequenzen sofort zu Proteinfamilien ausweiten können, statt diese zuerst in der bereits bestehenden Proteinkarte suchen zu müssen. Die Wahrscheinlichkeit innerhalb der um das Zielprotein herum kreierten Familie einen für die späteren Experimente geeigneten Verwandten zu finden ist ebenfalls höher.
Als Zielproteine filterten die NYCOMPS-Wissenschaftler schrittweise die Proteine heraus, die Eigenschaften von Membranporteinen aufwiesen. Dann erweiterten sie diese zu Proteinfamilien und wählten wiederum diejenigen Sequenzen, die für die Experimente besonders geeignet waren. All das geschah rein virtuell durch mathematische Vorhersagen und ganz ohne Experimente. Im Fall von ChbC blieben letztlich aus der Vielzahl an Sequenzen 25 aus 13 Organismen übrig. Erst diese 25 wurden dann im Labor näher untersucht. Letztlich führte eine der Sequenzen zum Erfolg – die sprichwörtliche „Nadel im Heuhaufen“ war gefunden.
Die neu aufgeklärte Struktur von ChbC hilft den Wissenschaftler nun, einen in Bakterien sehr wichtigen Weg des Zuckertransports in die Zelle besser zu verstehen: Das sogenannte „Phosphotransferasesystem“ (PTS). Bei diesem Transportweg wird das Zuckermolekül während des Transports in die Zelle mit einem Phosphatrest modifiziert. Diese Modifizierung ist zum einen der erste Schritt für die spätere Energiegewinnung aus dem Zucker, zum anderen verhindert sie, dass das Zuckermolekül einfach wieder aus der Zelle austritt. Phosphotransferasesysteme kommen in sehr vielen Bakterienarten vor und beeinflussen eine Vielzahl an zellulären Stoffwechselwegen. Sie sind daher ein gutes potentielles Angriffsziel für Antibiotika.
Die Struktur von ChbC zeigt beispielhaft, wie solche Transportsysteme funktionieren könnten: Die Region von ChbC, die das zu transportierende Zuckermolekül bindet, ähnelt in ihrer Struktur der eines anderen Transporters, der nicht mit ChbC verwandt ist und dessen Transportmechanismus bereits besser erforscht wurde: Dem Protein GltPh. Die Idee: Der Transportmechanismus von ChbC könnte ähnlich funktionieren wie bei GltPh.
Zuvor war der genaue Transportmechanismus von Phosphotransferasesystemen unbekannt. Nun vermuten die Wissenschaftler, dass der Zuckertransport bei ChbC in drei Schritten verläuft. Im ersten, „nach Außen offenen“ Zustand, bindet das Protein den zu transportierenden Zucker. Dann klappt die Region, an der der Zucker hängt, in einen Zwischenzustand um, der näher an der Innenseite der Zellmembran liegt, aber noch nicht mit dem Zellinneren in Kontakt steht. Im letzten Stadium schließlich kann der Zucker nun modifiziert und ins Zellinnere entlassen werden. Für die Bewegung von einem Zustand in den nächsten könnte eine einzelne Transportdomäne verantwortlich sein, die sich relativ zum feststehenden Rest des Proteins bewegt.
Die Arbeiten zu dieser Publikation wurden unterstützt aus Mitteln der US National Institutes of Health. NYCOMPS ist Teil der Protein Structure Inititive (PSI-2) des National Institute of General Medical Sciences. Burkhard Rost ist Alexander von Humboldt-Professor und Mitglied des Institute for Advanced Study der TU München.
Originalpublikation:
Crystal structure of a phosphorylation-coupled saccharide transporter
Yu Cao, Xiangshu Jin, Elena J. Levin, Hua Huang, Yinong Zong, Matthias Quick, Jun Weng, Yaping Pan, James Love, Marco Punta, Burkhard Rost, Wayne A. Hendrickson, Jonathan A. Javitch, Kanagalaghatta R. Rajashankar, Ming Zhou
Nature, Onlineveröffentlichung, 06.04.2011
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















