Kleine Hitzeschock-Proteine als Vorbild für Medikamente gegen Alzheimer
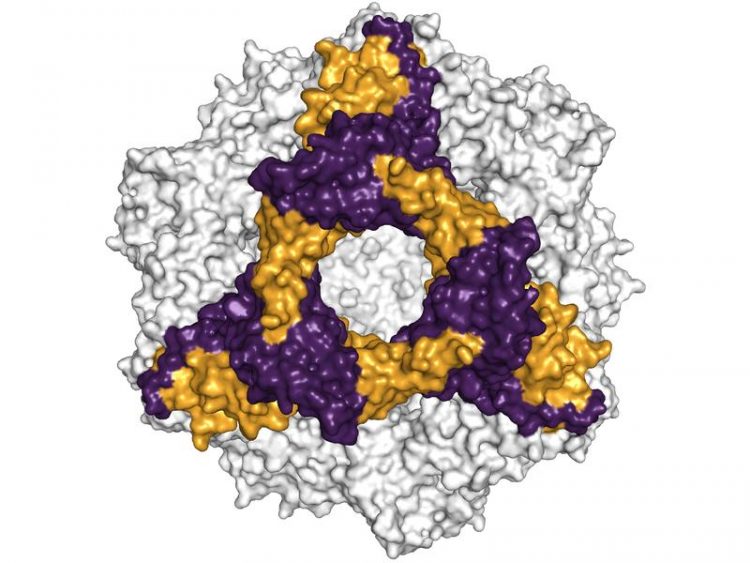
Räumliche Struktur des alphaB-Crystallins, eine hexamere Untereinheit ist farblich heraus gehoben Bild: Andi Mainz / TUM
Kleine Hitzeschockproteine sind die „Katastrophenhelfer“ der Zelle. Bei starker Hitze oder Schädigung durch Strahlung verlieren lebenswichtige Proteine der Zelle ihre Struktur und verkleben zu einem großen Knäuel.
Hat sich ein solcher Haufen einmal gebildet gibt es kein Zurück mehr – die Proteine werden unbrauchbar und die Zelle droht zu sterben. Kleine Hitzeschockproteine jedoch binden an die aus der Form geratenen Proteine bevor diese verklumpen können und halten sie in einem löslichen Zustand – solange, bis deren korrekte Form wieder hergestellt werden kann.
Vielversprechende Kandidaten für neue Therapeutika
Die Helferproteine sind bei ihrer Arbeit wahre Vielseitigkeitskünstler. Sie sind in der Lage, eine große Zahl ganz unterschiedlicher fehlgefalteter Proteine zu binden und vor dem Verklumpen zu bewahren. Hierzu gehören unter anderem auch jene potentiell krank machenden Eiweiße, die sich bei neurodegenerativen Krankheiten in der Zelle ansammeln – etwa die beta-Amyloide, die sich in den Nervenzellen von Alzheimerkranken zu langen Fibrillen zusammen lagern. Auch mit anderen Erkrankungen des Nervensystems wie der Parkinson Krankheit oder Multiple Sklerose werden kleine Hitzeschockproteine in Verbindung gebracht.
Zwar ist noch unklar, welche Rolle die Katastrophenhelfer in den einzelnen Krankheitsbildern genau spielen. Bereits jetzt werden sie jedoch als Vorbild für Wirkstoffe neuer Medikamente diskutiert. Wäre der genaue Mechanismus, mit dem die kleinen Hitzeschockproteine an ihre krank machenden Partner binden bekannt, könnten Wissenschaftler dieses Wissen dazu nutzen um Wirkstoffe zu entwickeln, die diesen Mechanismus verwenden, um die Krankheiten zu bekämpfen.
Zwei Wege gegen das Chaos
Nun ist es Forschern um Bernd Reif, Professor an der Fakultät für Chemie der Technischen Universität München (TUM) und Gruppenleiter am Helmholtz-Zentrum München, gelungen, genau diesen Mechanismus aufzuklären. Mit Hilfe einer verfeinerten Technik der Festkörper-Kernspinresonanzspektroskopie (Festkörper-NMR) konnten sie im kleinen Hitzeschockprotein alpha B-Crystallin erstmals jene Stellen identifizieren, mit denen das Protein an das beta-Amyloid bindet.
Es ist die erste direkte Strukturanalyse eines vollständigen kleinen Hitzeschockproteins in Interaktion mit einem Bindungspartner, denn die Katastrophenhelfer machen es ihren Beobachtern nicht leicht. „Alpha B-Crystallin liegt in mehreren Formen gleichzeitig vor, die aus 24, 28, oder 32 Untereinheiten bestehen und in denen fortlaufend Einheiten ausgetauscht werden“, erklärt Reif. „Außerdem hat es ein großes Molekulargewicht. All diese Faktoren machen eine Strukturanalyse sehr schwierig.“
In enger Zusammenarbeit mit den TUM-Kollegen Johannes Buchner, Professor für Biotechnologie und Sevil Weinkauf, Professorin für Elektronenmikroskopie fand Reif heraus, dass das kleine Hitzeschockprotein für Wechselwirkungen mit dem beta-Amyloid eine bestimmte unpolare beta-Faltblatt Struktur in seiner Mitte benutzt und auf diese Weise an gleich zwei Stellen in dessen Aggregationsprozess eingreifen kann: Zum einen bindet es an einzelne gelöste beta-Amyloide und verhindert, dass sich diese zu Fibrillen zusammen lagern. Zum anderen „versiegelt“ es bereits bestehende Fibrillen, so dass sich hier keine weiteren Amyloide mehr anlagern können.
Vorlage zum Bau künstlicher Proteine
Das Wissen über den genauen Bindemechanismus des alpha B-Crystallins an das Alzheimer- Protein ist besonders für jene Forscher interessant, die es sich zum Ziel gesetzt haben mit Hilfe sogenannter „Protein Engineering“ Methoden neue Wirkstoffe zu entwickeln, die spezifisch an das beta-Amyloid und ähnliche Proteine binden. Würde man das neu gefundene beta-Faltblatt Motiv als Baustein in solche künstlich entworfenen Proteine einbauen, könnte deren Bindefähigkeit an die krank machenden Fibrillen verbessert werden – ein erster Schritt zu neuen Wirkstoffen gegen Alzheimer und andere neurodegenerative Krankheiten.
In zukünftigen Arbeiten wollen sich die Wissenschaftler um Reif die N-terminale Region des αB-Crystallins näher ansehen. Sie bindet – das haben Reif und seine Kollegen herausgefunden – jene Proteintypen, die sich anders als das beta-Amyloid ungeordnet zusammen lagern. Helfen wird den Forschern dabei ein neues NMR Zentrum, das derzeit am Campus Garching der Technischen Universität München entsteht und 2017 eingeweiht werden wird. Ein weiteres 5 Millionen Euro teures Gerät, das speziell auf Festkörper-NMR Methoden ausgerichtet ist, wird derzeit am Helmholtz-Zentrum in Neuherberg eingerichtet.
Die Forschungsarbeiten wurden gefördert vom Helmholtz-Zentrum München und der Deutschen Forschungsgemeinschaft (DFG) (SFB-1035 und Exzellenzcluster „Center for Integrated Protein Science Munich“ (CIPSM).
Publikation:
Andi Mainz, Jirka Peschek, Maria Stavropoulou, Katrin C. Back, Benjamin Bardiaux, Sam Asami, Elke Prade, Carsten Peters, Sevil Weinkauf, Johannes Buchner, Bernd Reif: The Chaperone alpha B-Crystallin Deploys Different Interfaces to Capture an Amorphous and an Amyloid Client,
Nature Structural Molecular Biology, DOI: 10.1038/nsmb.3108
Kontakt:
Prof. Dr. Bernd Reif
Technische Universität München
Fachgebiet Festkörper-NMR-Spektroskopie
Lichtenbergstr 4, 85747 Garching, Germany
Tel.: +49 89 289 13667 – E-Mail: bernd.reif@helmholtz-muenchen.de
http://www.ocb.ch.tum.de Website der Arbeitsgruppe an der TU München
https://www.helmholtz-muenchen.de/en/stb/research/groups/research-group-reif/hom… Website der Arbeitsgruppe am Helmholtz Zentrum München
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Anlagenkonzepte für die Fertigung von Bipolarplatten, MEAs und Drucktanks
Grüner Wasserstoff zählt zu den Energieträgern der Zukunft. Um ihn in großen Mengen zu erzeugen, zu speichern und wieder in elektrische Energie zu wandeln, bedarf es effizienter und skalierbarer Fertigungsprozesse…

Ausfallsichere Dehnungssensoren ohne Stromverbrauch
Um die Sicherheit von Brücken, Kränen, Pipelines, Windrädern und vielem mehr zu überwachen, werden Dehnungssensoren benötigt. Eine grundlegend neue Technologie dafür haben Wissenschaftlerinnen und Wissenschaftler aus Bochum und Paderborn entwickelt….

Dauerlastfähige Wechselrichter
… ermöglichen deutliche Leistungssteigerung elektrischer Antriebe. Überhitzende Komponenten limitieren die Leistungsfähigkeit von Antriebssträngen bei Elektrofahrzeugen erheblich. Wechselrichtern fällt dabei eine große thermische Last zu, weshalb sie unter hohem Energieaufwand aktiv…





















