Kalkalgen: Ein Adressschild für Calcium
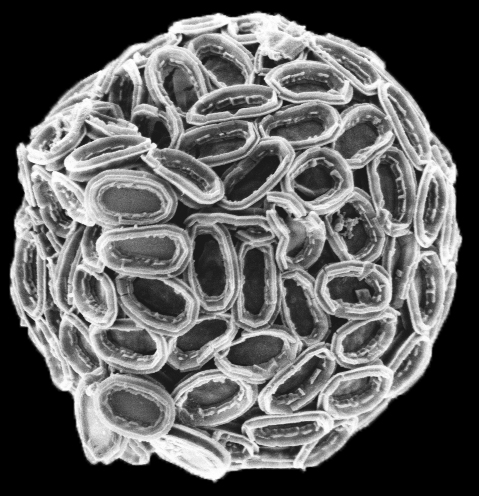
Die Kalkalge Pleurochrysis carterae André Scheffel u. Damien Faivre / MPI für molekulare Pflanzenphysiologie
Kalkalgen machen Design für die Massenproduktion. Obwohl selbst die schwersten Exemplare der Meeresbewohner weniger als ein Milliardstel Gramm wiegen, produzieren alleine die einzelligen Kalkalgen weltweit Calciumcarbonat, also Kalk, mit einer Masse von bis zu 500 Millionen Tonnen.
Das entspricht etwa einem Drittel der weltweiten Stahlproduktion pro Jahr. Den Kalk bauen sie in Form von einigen Nanometer großen Kristallen –Fachleute sprechen von Calcit – in filigrane Strukturen ein, die am Reißbrett entworfen sein könnten. Die architektonischen Meisterwerke sind allerdings nicht das Ergebnis eines planvollen Vorgehens, sondern allein ein Werk der Biochemie der Mikroorganismen.
„Wir haben einen biochemischen Mechanismus entdeckt, der bewirkt, dass sich die Kristalle dort bilden, wo sie gebraucht werden“, sagt André Scheffel, Wissenschaftler am Max-Planck-Institut für molekulare Pflanzenphysiologie und Leiter der aktuellen Studie.
Untersucht hat das Forscherteam, zu dem auch Wissenschaftler des Max-Planck-Instituts für Kolloid- und Grenzflächenforschung sowie des GeoForschungsZentrums Potsdam gehörten, die Kalkalge Pleurochrysis carterae. Sie gehört zu den Coccolithophoriden, einer Gruppe von einzelligen Meeresalgen, die ihren Namen den Kalkschuppen – Coccolithen genannt – auf ihrer Oberfläche verdanken.
Diese winzigen Kalkschuppen besitzen eine Bodenplatte, die aus organischem Material, vor allem Cellulosefasern, besteht und wie ein Tortenboden von einem Rand eingefasst wird. An diesem Rand, und nur dort, sind abwechselnd Calcit-Kristalle mit zwei unterschiedlichen Formen angeordnet.
Die Coccolithen werden im Inneren der Zelle in einem speziellen Vesikel, einem von einer Membran umschlossenen Raum, gebildet. Die fertigen Coccolithen werden dann aus der Zelle ausgeschleust und im Coccolithenpanzer integriert, der jede Algenzelle umgibt.
Vielfachzucker transportieren nur Calcium und kein Calciumcarbonat
„Wie sich die regelmäßige Struktur in dem speziellen Membranraum bildet, war bislang unklar“, sagt André Scheffel. „Bislang hielt man die chemische Struktur der Bodenplatte für ausschlaggebend, damit sich die Kalk-Kristalle nur am Rand der Coccolithen bilden“, so Scheffel. Die Potsdamer Forscher haben diese Vermutung nun mit Versuchen im Reagenzglas widerlegt.
Zunächst lösten sie die Kristalle von isolierten Coccolithen auf und trennten das freigesetzte organische Material in die Bodenplatte sowie die löslichen Vielfachzucker und Proteine. Anschließend boten sie zum einen der Bodenplatte alleine, zum anderen der Bodenplatte zusammen mit den löslichen organischen Komponenten verschieden Ionen an: Calcium-, Carbonat- sowie andere Metallionen.
Wie die Experimente zeigten, bilden sich an der Bodenplatte alleine keine Kristalle. „Damit die Kalk-Kristalle an der richtigen Stelle entstehen, kommt es interessanter Weise auf die löslichen negativ geladenen Vielfachzucker an“, sagt André Scheffel. Diese transportieren aber nur das positiv geladene Calcium und kein Calciumcarbonat zum Rand der Bodenplatte und lagern sich mit ihm dort in Form kleiner Klümpchen ab. Die Proteine sind an der Navigation demnach unbeteiligt.
Frühere Untersuchungen hatten zwar ergeben, dass die löslichen Bestandteile bei der Kristallisation von Calciumcarbonat mitmischen. Welche Rolle Vielfachzucker und Proteine dabei genau spielen, war bislang aber nicht bekannt.
Wie die Forscher außerdem festgestellt haben, funktioniert die zielsichere Zustellung nur mit Calcium, andere Metallionen wie Magnesium oder Natrium verteilen die Polysaccharide wahllos auf der Bodenplatte oder liefern sie dort gar nicht ab. Das ist in etwa so, als könnte ein Logistik-Unternehmen nur genau eine Fracht zuverlässig zur richtigen Adresse liefern, weil nur diese Ladung bei der Navigation helfen kann.
Anregungen für die Nanotechnologie
„Unsere Erkenntnisse sind wahrscheinlich nicht nur für P. carterae relevant, sondern für alle Organismen, die Kalk verarbeiten: andere Kalkalgen, Muscheln und Seeigel“, sagt André Scheffel. „Möglicherweise handelt es sich sogar um einen Mechanismus, der bei der Biomineralisation generell eine Rolle spielt, also auch bei der Bildung von Zähnen und Knochen.“ Denn auch hier ist bislang unklar, warum die mineralischen Kristalle dort entstehen, wo sie hingehören.
Inwieweit auch in anderen Organismen, die Biominerale bilden, lösliche Biomoleküle wie etwa Vielfachzucker daran beteiligt sind, dass sich die Kristalle an der richtigen Stelle bilden, wollen die Forscher nun untersuchen. Außerdem möchten sie herausfinden, welche Bestandteile der Bodenplatte und der löslichen Vielfachzucker im Zusammenspiel mit Calcium für dessen zielgenaue Zustellung sorgen. Zu klären bleibt zudem, wie P. carterae aus den Klumpen von Calcium und Zucker Kalk-Kristalle mit zwei verschiedenen Formen entstehen lässt.
Diese Fragen wollen André Scheffel und seine Kollegen nicht nur beantworten, weil Kalkalgen mit dem Kalk auch große Mengen Kohlendioxid binden und daher eine enorme ökologische Bedeutung haben. Dahinter zu kommen, wie Meerestiere Kalk-Konstruktionen bauen, könnte auch für technische Anwendungen nützlich sein. Die Kniffe der Natur dürften nämlich auch Materialwissenschaftlern Anregungen geben, wie sich auf präzise Weise winzige Strukturen für die Nanotechnologie erzeugen lassen.
Kontakt:
Dr. André Scheffel
Max-Planck-Institut für molekulare Pflanzenphysiologie
E-Mail: scheffel@mpimp-golm.mpg.de
Tel.: +49 331 567-8358
Originalveröffentlichung:
Assaf Gal, Richard Wirth, Joachim Kopka, Peter Fratzl, Damien Faivre und André Scheffel
Macromolecular recognition directs calcium ions to coccolith mineralization sites
Science, 5. August 2016; doi: 10.1126/science.aaf7889
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Nanofasern befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…





















