Hauptakteur der Proteinfaltung identifiziert
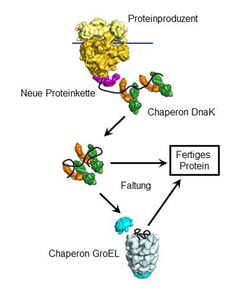
Das Chaperon DnaK bindet neue Proteine und führt deren Faltung herbei. Proteine, die es nicht falten kann, transportiert DnaK zu GroEL, einer hochspezialisierten Faltungsmaschine. Grafik: F.-Ulrich Hartl / Copyright: MPI für Biochemie<br>
Um ihre Aufgaben erfüllen zu können, müssen sie in eine komplexe dreidimensionale Struktur gefaltet werden. Wissenschaftler am Max-Planck-Institut für Biochemie (MPIB) in Martinsried haben jetzt einen der Hauptakteure dieses Faltungsprozesses analysiert: das molekulare Chaperon DnaK.
„Das Verständnis dieser Mechanismen ist von großem Interesse, vor allem im Licht der vielen Krankheiten wie Alzheimer und Parkinson, bei denen die Proteinfaltung nicht korrekt abläuft“, sagt F.-Ulrich Hartl, MPIB-Direktor. Ihre Ergebnisse wurden jetzt in Cell Reports veröffentlicht.
Proteine sind für fast alle biologischen Funktionen verantwortlich. Die Zellen des menschlichen Körpers produzieren kontinuierlich Tausende unterschiedliche Proteine in Form von langen Aminosäureketten. Damit ein Protein funktionsfähig ist, müssen diese Ketten in die jeweils korrekte, dreidimensionale Struktur gefaltet werden. Wenn in diesem komplexen Prozess Fehler auftreten, können nutzlose oder gar gefährliche Proteinklumpen entstehen. Alle Zellen, von der Bakterienzelle bis hin zu menschlichen Zellen, haben daher ein Netzwerk aus molekularen „Anstandsdamen“, die Chaperone , entwickelt. Chaperone, selbst auch Proteine, helfen anderen Proteinen, sich richtig zu falten.
MPIB-Wissenschaftler haben jetzt die Organisation dieses Netzwerks in dem Bakterium Escherichia coli untersucht. Durch Analysen des Proteoms (Gesamtheit aller Proteine) konnten die Forscher zeigen, wie verschiedene Chaperone während des Faltungsprozesses zusammenarbeiten. „Wir konnten das Hsp70-Protein DnaK als Hauptakteur des Netzwerkes identifizieren“, erklärt F.-Ulrich Hartl. „Es funktioniert wie eine Art Dreh- und Angelpunkt.“ DnaK bindet bis zu 700 verschiedene Proteinketten während sie gebildet werden. Darüber hinaus führt DnaK die Faltung der meisten dieser Proteinketten herbei. Die, die es nicht falten kann, werden zu einem anderen Chaperon transportiert: dem tonnenförmigen GroEL, eine hoch spezialisierte Faltungsmaschine. GroEL bildet einen Nano-Käfig, in dem einzelne Proteinketten vorübergehend eingeschlossen sind. So können sie sich ohne störende Einflüsse von außen falten.
Fehler im Chaperon-Netzwerk
Die Wissenschaftler haben außerdem untersucht, was passiert, wenn das Chaperon-Netzwerk gestört wird. Entfernen die Forscher beispielsweise GroEL aus den Zellen, häufen sich seine ‚Kunden-Proteine‘ an DnaK an. DnaK überführt sie anschließend zu Proteasen. Das sind Proteine, die für den Abbau von defekten oder nicht mehr benötigten Proteinen verantwortlich sind. „Anscheinend erkennt DnaK, dass diese Proteinketten niemals zu funktionsfähigen Molekülen heranreifen werden“, sagt der Biochemiker. Ähnliche, jedoch sehr viel kompliziertere Chaperon-Netzwerke kontrollieren das Proteom menschlicher Zellen. Das Verständnis der zugrundeliegenden Mechanismen ist von großem Interesse – besonders vor dem Hintergrund der vielen neurodegenerativen Krankheiten, bei denen der Faltungsprozess nicht fehlerfrei abläuft.
Originalpublikation
G. Calloni, T. Chen, S.M. Schermann, H. Chang, P. Genevaux, F. Agostini, G.G. Tartaglia, M. Hayer-Hartl and F.U. Hartl: DnaK Functions as a Central Hub in the E. coli Chaperone Network. Cell Reports, March 8, 2012
DOI: 10.1016/j.celrep.2011.12.007
Kontakt:
Prof. Dr. F.-Ulrich Hartl
Zelluläre Biochemie
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
E-Mail: uhartl@biochem.mpg.de
Anja Konschak
Öffentlichkeitsarbeit
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
Tel. +49 89 8578-2824
E-Mail: konschak@biochem.mpg.de
Media Contact
Weitere Informationen:
http://www.biochem.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Anlagenkonzepte für die Fertigung von Bipolarplatten, MEAs und Drucktanks
Grüner Wasserstoff zählt zu den Energieträgern der Zukunft. Um ihn in großen Mengen zu erzeugen, zu speichern und wieder in elektrische Energie zu wandeln, bedarf es effizienter und skalierbarer Fertigungsprozesse…

Ausfallsichere Dehnungssensoren ohne Stromverbrauch
Um die Sicherheit von Brücken, Kränen, Pipelines, Windrädern und vielem mehr zu überwachen, werden Dehnungssensoren benötigt. Eine grundlegend neue Technologie dafür haben Wissenschaftlerinnen und Wissenschaftler aus Bochum und Paderborn entwickelt….

Dauerlastfähige Wechselrichter
… ermöglichen deutliche Leistungssteigerung elektrischer Antriebe. Überhitzende Komponenten limitieren die Leistungsfähigkeit von Antriebssträngen bei Elektrofahrzeugen erheblich. Wechselrichtern fällt dabei eine große thermische Last zu, weshalb sie unter hohem Energieaufwand aktiv…





















