Freie-Elektronen-Laser enthüllt detaillierte Architektur von Proteinen
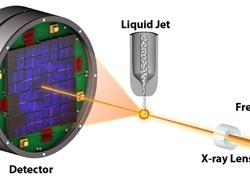
Schematische Darstellung des Messaufbaus am “Coherent X-ray Imaging” Strahlrohr der Linac Coherent Light Source. Millionen winziger Kristalle werden von oben in einem dünnen Flüssigkeitsstrahl in den Röntgenstrahl des Freie-Elektron-Lasers injiziert. Die Beugungsbilder, die entstehen, wenn ein Kriställchen von einem Freie-Elektron-Laser-Blitz getroffen wird, werden auf dem Detektor registriert (links). © <br>
Im Jahr, in dem sich Max von Laues Entdeckung der Röntgenbeugung zur Aufklärung der Atomstruktur von Molekülen zum 100. Mal jährt, hat ein internationales Forscherteam winzige Proteinkristalle mit Hilfe ultrakurzer Röntgenpulse aus dem weltweit ersten Freie-Elektronen-Laser für harte Röntgenstrahlung analysiert, der „Linac Coherent Light Source“ des US-Energieministeriums in Stanford.
Die Untersuchung zeigt das enorme Potenzial von Freie-Elektronen-Lasern, durch Belichtung winziger Kristalle mit ultrakurzen Röntgenpulsen hochdetaillierte Strukturinformation von Makromolekülen zu erhalten – und das, obwohl die Kristalle durch die gigantische Intensität der Laser zerstört werden. In der aktuellen Untersuchung enthüllt die Strukturanalyse Details mit einer räumlichen Auflösung von 0,2 Millionstel Millimetern.
Das Team, dem Forscher des Max-Planck-Instituts für medizinische Forschung in Heidelberg und der Max-Planck-Advanced Study Group in Hamburg angehören, konnte belegen, dass die neuen Daten mit den Daten aus konventionellen Röntgenquellen für bekannte große Kristalle übereinstimmen. Freie-Elektronen-Laser sind also ein wichtiges neues Werkzeug für strukturbiologische Untersuchungen großer makromolekularer Komplexe und Membranproteine, von denen viele für die Entwicklung von Arzneimitteln bedeutsam sind.
Freie-Elektronen-Röntgenlaser sind extrem leistungsstarke neuartige Röntgenquellen, die ultrakurze Lichtblitze enorm hoher Intensität erzeugen. Die Intensität eines solchen Röntgenpulses ist mehr als eine Milliarde Mal höher als die der stärksten konventionellen Röntgenquellen, und das bei einer tausendfach kürzeren Pulsdauer von nur einigen Billiardstel Sekunden (Femtosekunden). Diese Eigenschaften bieten Forschern völlig neue Möglichkeiten zur Erforschung der Nanowelt, einschließlich der Struktur biologischer Materialien.
Das Wissen über die dreidimensionale räumliche Architektur von Molekülen beruht größtenteils auf der Röntgenkristallografie. Dabei wird das Signal des an den Molekülen gestreuten Röntgenlichts verstärkt, indem diese in bis zu einigen Zehntel Millimeter großen Kristallen angeordnet werden. So große Kristalle sind jedoch von Biomolekülen aufgrund ihrer weitverbreiteten Flexibilität und Instabilität meistens nur sehr schwer herzustellen, Dazu kommt, dass sich Biomoleküle oft nur in sehr geringen Mengen anreichern lassen. Freie-Elektronen-Laser können dagegen auch Daten von winzigen Kristallen liefern, die ihre strukturellen Geheimnisse mit herkömmlichen Verfahren auf Grund der durch die Strahlung verursachten Schädigung nicht preisgeben können. Diese winzigen Kristalle werden zwar auch durch die enorm starken Lichtblitze der Freie-Elektronen-Laser vollständig zerstört, die ultrakurzen Pulse können jedoch die Kristalle durchlaufen und ein auswertbares Beugungssignal erzeugen, bevor die ersten Schäden auftreten.
Im Gegensatz zur konventionellen Kristallografie, bei der ein einziger großer Kristall im Strahl rotiert wird, werden bei diesem Verfahren Kristalle mit Hilfe eines Flüssigkeitsstrahls in den Freie-Elektronen-Laserstrahl injiziert, welche nacheinander der Strahlung ausgesetzt werden. Dieses Konzept der seriellen Femtosekunden-Kristallografie wurde zuvor vom gleichen Forscherteam an der „Linac Coherent Light Source“ in Stanford mit dem von der Max Planck Advanced Study Group entwickelten „CAMP“-Instrument demonstriert. Damals gab es jedoch nur relativ langwellige Röntgenstrahlen, was die Detailgenauigkeit der Ergebnisse begrenzte.
Erst seit Kurzem ist an der „Linac Coherent Light Source“ dank dem neuen „Coherent X-ray Imaging“ Instrument der Einsatz kurzwelliger Röntgenstrahlen möglich, so dass jetzt auch Details im atomaren Aufbau der Moleküle messbar sind. Als Test für das Verfahren wurde mit dem kleinen Protein Lysozym ein bekanntes Modellsystem untersucht, dessen Raumstruktur erstmals bereits 1967 aufgeklärt wurde.
Die Forscher setzten mehr als 10000 Beugungsbilder von nur einem tausendstel Millimeter messenden Kristallen zu einem Datensatz zusammen. Er stimmte sehr gut mit Referenz Daten überein, die von hundertfach größeren Lysozym-Kristallen mit konventionellen Methoden gesammelt wurden. Zudem wurden keine signifikanten Strahlungsschäden entdeckt. Dieses Experiment zeigt, dass der Freie-Elektronen-Laser ein wichtiges neues Hilfsmittel für die biologische Forschung an großen makromolekularen Komplexen ist. Er eröffnet völlig neue Perspektiven für die strukturelle Biologie“, sagt die Leiterin des Max-Planck-Teams Ilme Schlichting. Da kleine Kristalle typischerweise einfacher herzustellen sind als größere, ist dies von weitreichender Bedeutung für alle Untersuchungen von schwer zu kristallisierenden Molekülen – dazu gehören etwa 60 Prozent aller Proteine. Viele davon sind wichtige Angriffspunkte für neue Medikamente.
Ansprechpartner
Prof. Dr. Ilme Schlichting
Max-Planck-Institut für medizinische Forschung
Telefon: +49 6221 486-500
Fax: +49 6221 486-585
Email: ilme.schlichting@mpimf-heidelberg.mpg.de
Lukas Lomb
Max-Planck-Institut für medizinische Forschung
Telefon: +49 6221 486-519
Email: lukas.lomb@mpimf-heidelberg.mpg.de
Originalveröffentlichung
Boutet et al.
High-Resolution Protein Structure Determination by Serial Femtosecond Crystallography
Science, 1. Juni 2012
Media Contact
Weitere Informationen:
http://www.mpg.de/5825076/freie-elektronen-laserAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















