Forscher entschlüsseln Serotonin-Rezeptor bei Raumtemperatur
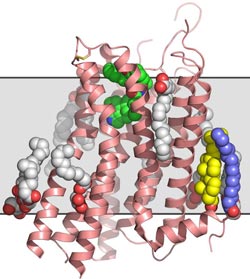
Struktur des Serotoninrezeptors mit angekoppeltem Ergotamin (grün), Lipiden (grau), Palmitinsäure (blau) und Cholesterol (gelb). Die ungefähre Lage der Zellmembran ist grau im Hintergrund skizziert.<br><br><br>Illustration: Vadim Cherezov/The Scripps Research institute<br>
Die Untersuchung enthüllt die Dynamik des Rezeptors nahe seiner Betriebstemperatur und zeigt damit seine physiologische Funktion besser als vorangegangene Analysen in flüssigem Stickstoff bei rund minus 173 Grad Celsius, wie die Gruppe um Prof. Vadim Cherezov vom kalifornischen Scripps-Institut im Fachjournal „Science“ berichtet. Damit könnten sich auch neue Ansatzpunkte für maßgeschneiderte Medikamente ergeben. Zudem eröffnet die Untersuchung neue Analysemöglichkeiten für große Biomoleküle.
Serotonin ist ein wichtiger Botenstoff des Nervensystems und an der Regulierung zahlreicher Körperfunktionen beteiligt, darunter Blutdruck, Verdauung und Augeninnendruck, aber auch Stimmung, Appetit und Suchtverhalten. Der Serotonin-Rezeptor ist daher ein wichtiges Ziel für Arzneimittel. Mit Kenntnis seiner molekularen Struktur lassen sich möglicherweise Medikamente maßschneidern, die nach dem Schlüssel-Schloss-Prinzip an den Rezeptor koppeln.
„Forscher sind bereits seit vielen Jahrzehnten daran interessiert, die Struktur des Serotonin-Rezeptors zu entschlüsseln“, sagt Koautor Cornelius Gati, Doktorand aus der Gruppe von Prof. Henry Chapman am Hamburger Center for Free-Electron Laser Science (CFEL), einer Gemeinschaftseinrichtung von DESY, der Universität Hamburg und der Max-Planck-Gesellschaft. Erst in diesem Jahr hat jedoch eine Gruppe, an der ebenfalls Cherezov beteiligt ist, die Rezeptorstruktur mit einer klassischen Analyse an einer sogenannten Synchrotron-Strahlungsquelle entschlüsselt.
Für derartige Analysen müssen biologische Moleküle üblicherweise zu Kristallen herangezüchtet werden, was insbesondere bei sogenannten Membranproteinen wie dem Serotoninrezeptor nur schlecht oder manchmal auch gar nicht funktioniert und sehr aufwendig ist. Diese Kristalle werden dann schockgefroren und mit der Röntgenstrahlung von Synchrotronquellendurchleuchtet. Der Proteinkristall erzeugt im Röntgenlicht ein charakteristisches Streumuster, aus dem sich seine Struktur berechnen lässt.
Die Forscher um Cherezov nutzten dagegen den derzeit weltweit stärksten Röntgenlaser LCLS am US-Beschleunigerzentrum SLAC in Kalifornien. Der Röntgenlaser erzeugt 120 helle Röntgenblitze pro Sekunde, von denen jeder milliardenfach heller ist als das Licht konventioneller Synchrotronquellen. Mit diesen hellen Blitzen lassen sich auch kleinste Kristalle durchleuchten und analysieren. Zudem müssen sie nicht tiefgekühlt werden, da sie durch die intensiven Röntgenblitze ohnehin verdampfen. Zuvor geben sie jedoch noch ihre Strukturinformation preis, und das mit größerer Detailtreue als an einem Synchrotron. „Die Röntgenpulse sind kürzer als 30 Femtosekunden, in dieser Zeit fliegt Licht gerade zehn Mikrometer weit“, erläutert Chapman. „Jeder einzelne dieser unglaublich kurzen aber starken Röntgenblitze überholt buchstäblich alle Strahlenschäden des verdampfenden Kristalls und liefert uns deutliche und tadellose Strukturinformationen.“
„Solche bei Raumtemperatur analysierten Strukturen sollten den Zustand der Proteine in ihrer natürlichen Umgebung besser widerspiegeln und könnten als bessere Vorlagen für die strukturbasierte Medikamentenentwicklung dienen“, betont Cherezov.
Für die Untersuchung hatten die Forscher winzige Kristalle des Serotoninrezeptors in Verbindung mit dem Wirkstoff Ergotamin gezüchtet, einem Migränemittel. Wegen der Schwierigkeiten beim Kristallisieren von Membranproteinen verwendeten die Wissenschaftler eine Art künstliche Zellmembran, die sogenannte Lipid Cubic Phase (LCP), in der sich zumindest Mikrokristalle züchten ließen. Dieses gelartige, viskose Medium lässt sich jedoch nicht so einfach in den Strahl des Röntgenlasers sprühen, wie eine wässrige Lösung, es ist deutlich zäher als Zahnpasta. An der Arizona State University entwickelten Forscher daher zunächst einen speziellen Injektor, der auch eine derart zähe Paste gezielt und in kleiner Menge durch den Röntgenlaserstrahl schießen kann.
„Der ,Zahnpasta´-Injektor, der von Uwe Weierstall an der Arizona State University entworfen wurde, kann die Fließrate kontrollieren und anpassen, so dass es nur wenig Ausschuss zwischen den LCLS-Pulsen gibt und hundert- bis tausendmal weniger Kristalle für dieselbe Analyse nötig sind als bei bisher verwendeten Flüssigkeitsinjektoren“, betont Cherezov. Auf diese Weise ließen sich mehr als 150 000 Beugungsmuster individueller Kristalle aufnehmen, die in steter Folge von dem Injektor durch den Röntgenstrahl geschossen wurden. Das gigantische Datenvolumen wurde von Gati mit einer speziell für diesen Zweck entwickelte Software namens CrystFEL verarbeitet.
Das Forscherteam verglich die Strukturdaten aus dem Röntgenlaser mit jenen aus der Standardanalyse an der Synchrotron-Strahlungsquelle. „Eines unserer wichtigsten Resultate ist, dass die am Röntgenlaser gewonnene Strukturinformation nahezu identisch ist mit der Strukturbestimmung aus der traditionellen Kristallographie, wobei am Röntgenlaser rund 100 Mal kleinere Kristalle bei Raumtemperatur verwendet wurden“, erklärt Cherezov. Die Unterschiede in der Struktur gehen unter anderem darauf zurück, dass bestimmte flexible Schlaufen des Rezeptors im tiefgekühlten Zustand starrer erscheinen als bei Raumtemperatur. Deren Dynamik spielt eine Rolle bei der Bindung an andere Biomoleküle, die Signale von der Umgebung ins Innere der Zelle vermitteln.
Die Untersuchung eröffnet neue Analysemöglichkeiten für eine ganze Klasse von Biomolekülen. Der Serotoninrezeptor gehört zur Gruppe der sogenannten G-Protein gekoppelten Rezeptoren (GPCR). Diese Gruppe von rund 800 Rezeptoren spielt bei der Signalvermittlung von der Umgebung ins Innere von biologischen Zellen eine wichtige Rolle und ist besonders interessant für die Arzneiforschung. Rund 30 bis 40 Prozent aller verschreibungspflichtigen Medikamente zielen auf G-Protein gekoppelte Rezeptoren ab.
„Dies ist die erste Kristallstrukturanalyse eines menschlichen Membranproteins bei Raumtemperatur“, betont Gati. „Die Studie zeigt, dass man bei Raumtemperatur Mikrokristalle von Biomolekülen vermessen kann und so realistischere Resultate bekommt. Damit lässt sich möglicherweise auch die Entwicklung von Medikamenten verbessern, weil man mehr von der Dynamik des Rezeptors sieht.“
Diesen Weg wird auch das Hamburger Center for Ultrafast Imaging CUI auf dem DESY-Campus verfolgen, dem auch Gatiund Chapman angehören, und das diese Arbeit zu einem Teil unterstützt hat. Das CUI ist eine Kooperation der Universität Hamburg mit DESY, der Max-Planck-Gesellschaft, dem Europäischen Molekularbiologielabor EMBL und der European XFEL GmbH.
Das Deutsche Elektronen-Synchrotron DESY ist das führende deutsche Beschleunigerzentrum und eines der führenden weltweit. DESY ist Mitglied der Helmholtz-Gemeinschaft und wird zu 90 Prozent vom BMBF und zu 10 Prozent von den Ländern Hamburg und Brandenburg finanziert. An seinen Standorten in Hamburg und Zeuthen bei Berlin entwickelt, baut und betreibt DESY große Teilchenbeschleuniger und erforscht damit die Struktur der Materie. Die Kombination von Forschung mit Photonen und Teilchenphysik bei DESY ist einmalig in Europa.
Originalveröffentlichung
“Serial Femtosecond Crystallography of G Protein-Coupled Receptors”; Wei Liu et al; Science, 2013; DOI: 10.1126/science.1244142
Media Contact
Weitere Informationen:
http://www.desy.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Anlagenkonzepte für die Fertigung von Bipolarplatten, MEAs und Drucktanks
Grüner Wasserstoff zählt zu den Energieträgern der Zukunft. Um ihn in großen Mengen zu erzeugen, zu speichern und wieder in elektrische Energie zu wandeln, bedarf es effizienter und skalierbarer Fertigungsprozesse…

Ausfallsichere Dehnungssensoren ohne Stromverbrauch
Um die Sicherheit von Brücken, Kränen, Pipelines, Windrädern und vielem mehr zu überwachen, werden Dehnungssensoren benötigt. Eine grundlegend neue Technologie dafür haben Wissenschaftlerinnen und Wissenschaftler aus Bochum und Paderborn entwickelt….

Dauerlastfähige Wechselrichter
… ermöglichen deutliche Leistungssteigerung elektrischer Antriebe. Überhitzende Komponenten limitieren die Leistungsfähigkeit von Antriebssträngen bei Elektrofahrzeugen erheblich. Wechselrichtern fällt dabei eine große thermische Last zu, weshalb sie unter hohem Energieaufwand aktiv…





















