Erste Hilfe für gestresste Proteine
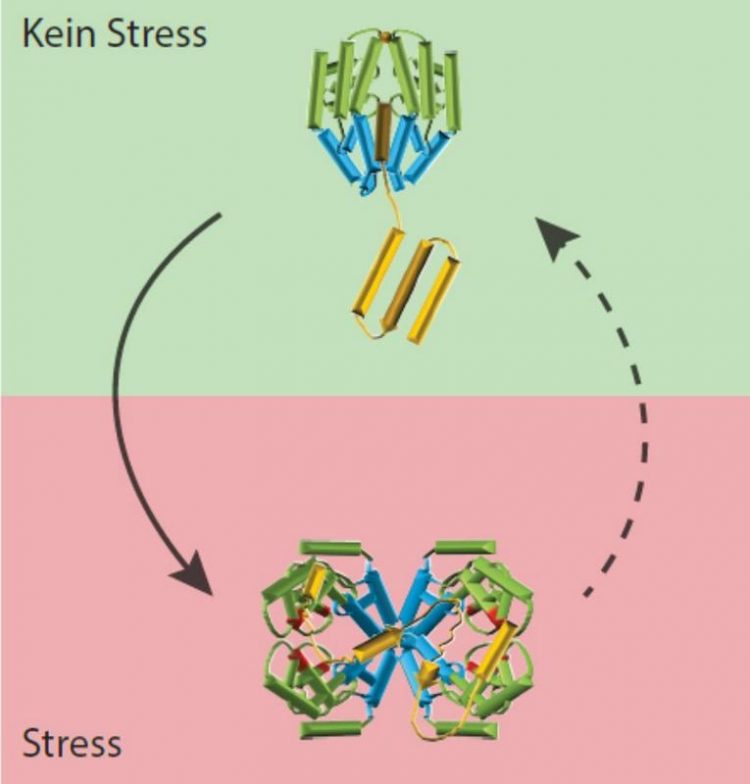
Bei oxidativem Stress (unten) ändert Get3 seine Form, lagert sich mit drei anderen Get3-Proteinen zusammen und arbeitet als Chaperon, um Proteine zu schützen. Grafik: Wilhelm Voth, UMG.
Mit Sauerstoff verbinden die meisten Menschen vor allem Positives: Jede einzelne Zelle des Körpers benötigt ihn. Tritt Sauerstoff jedoch in Form von reaktiven Radikalen, also Molekülen, auf, ist er extrem schädlich für den Körper. Man spricht dann von oxidativem Stress.
Er greift das Erbgut an oder verändert Proteine so, dass sie ihre Aufgaben nicht mehr ausführen können. Die Proteine sind den Sauerstoffradikalen jedoch nicht schutzlos ausgeliefert. Die Zellen können mit oxidativem Stress umgehen, ihre Proteine bleiben funktionstüchtig. Wie schaffen sie das?
Ein internationales Forscherteam unter der Leitung von Prof. Dr. Blanche Schwappach, Direktorin des Instituts für Molekularbiologie der Universitätsmedizin Göttingen (UMG) und Wissenschaftlerin am Göttinger Zentrum für Molekulare Biowissenschaften (GZMB), sowie Prof. Dr. Ursula Jakob, Department of Biological Chemistry der Universität Michigan (USA), hat jetzt herausgefunden, wie Zellen ihre molekularen Arbeiter bei oxidativem Stress trotzdem schützen können.
Ein Protein namens Get3 springt ein, wenn die eigentlichen Rettungskräfte durch den radikalen Sauerstoff außer Gefecht gesetzt sind. Get3 hat normalerweise eine andere Aufgabe in der Zelle. Wird es jedoch von reaktivem Sauerstoff angegriffen, verwandelt es sich selbst in einen Protein-Retter und lässt dafür seine ursprüngliche Aufgabe liegen. Die Forschungsergebnisse wurden im Oktober in der Fachzeitschrift „Molecular Cell“ veröffentlicht.
Orginalpublikation: Voth W, Schick M, Gates S, Li S, Vilardi F, Gostimskaya I, Southworth DR, Schwappach B, Jakob U. The Protein Targeting Factor Get3 Func-tions as ATP-Independent Chaperone under Oxidative Stress Conditions. Mol Cell. 2014 Oct 2;56(1):116-27. doi: 10.1016/j.molcel.2014.08.017. Epub 2014 Sep 18.
HILFE FÜR DIE HELFER
Proteine bestehen aus langen Ketten und funktionieren nur, wenn sie sich in eine komplexe dreidimensionale Form gefaltet haben. Unter Umständen verlieren Proteine diese wichtige Faltung jedoch und damit ihre Arbeitsfähigkeit. Dies passiert zum Beispiel, wenn es zu warm wird. Auch Sauerstoffradikale können Proteine aus der Form bringen. Diese aggressiven Sauerstoff-Verbindungen entstehen, wenn UV-Licht auf die Zellen trifft oder durch chemische Substanzen, die zum Beispiel in Zigarettenrauch enthalten sind. Kleine chemische Veränderungen durch die Radikale führen dazu, dass die Proteine ihre Faltung selbst nicht mehr aufrechterhalten können.
Doch Zellen wissen sich zu schützen: Droht ein Protein aus der Form zu geraten, eilen „Rettungs-Proteine“, sogenannte Chaperone, hinzu. Sie unterstützen es dabei, die Form zu wahren. Chaperone sind Proteine, die anderen Proteinen beim Heranreifen helfen, unerwünschte Kontakte unterbinden und Fehler korrigieren. Sie halten das hilfsbedürftige Protein so fest, dass es seine Faltung nicht verlieren kann. Das funktioniert in den meisten Fällen sehr zuverlässig. Dieser zelluläre Rettungsdienst versagt allerdings, wenn radikaler Sauerstoff im Spiel ist. Denn Radikale berauben die Zellen auch ihrer wichtigsten Energieträger, den ATP-Molekülen. Ohne ATP fehlt den Chaperonen der Treibstoff für ihre energieintensive Arbeit – sie können die beschädigten Proteine nicht mehr am Entfalten hindern. Die Zelle hat trotzdem einen Notfallplan.
Oxidativer Stress verwandelt Get3 in ein Rettungs-Protein
Für ihre Arbeit nutzten die Forscher aus Göttingen und Michigan Hefezellen. Sie eignen sich besonders gut für genetische und biochemische Studien und verhalten sich dabei ähnlich wie menschliche Zellen. Auf die Spur von Get3 kamen die Wissenschaftler, als sie Hefezellen untersuchten, denen dieses Protein fehlt. „Zellen ohne Get3 haben einen bemerkenswerten Defekt“, sagt Blanche Schwappach. Diese Zellen reagieren besonders empfindlich auf oxidativen Stress.“ Bisher war keinerlei Verbindung zwischen der Aufgabe, die Get3 erfüllt, und den zellulären Schutzmechanismen gegen radikalen Sauerstoff bekannt. Normalerweise ist Get3 dafür zuständig, bestimmte Proteine in Membranen der Zelle zu verankern. Diese Funktion hat nichts mit oxidativem Stress zu tun.
Bei ihren Arbeiten stellten die Forscher jedoch fest, dass Get3 seine Faltung grundlegend ändert, wenn es Sauerstoff ausgesetzt ist. In diesem Zustand konnte Get3 auch andere Proteine davor retten, ihre Faltung zu verlieren – es arbeitete also als Chaperon. Mehr noch: Anders als der zelluläre Rettungsdienst leistet Get3 Erste Hilfe ohne ATP. Es kann also auch bei oxidativem Stress anderen Proteinen beistehen. Dafür arbeitet es im Team: Vier oder mehr Get3-Chaperone tun sich zusammen und kümmern sich um ein beschädigtes Protein. „Entscheidend ist, dass Get3 zwischen seinen beiden Faltungen und Funktionen hin- und herwechseln kann“, sagt Wilhelm Voth, der an der Universitätsmedizin Göttingen und der Universität Michigan forscht. „Seine Veränderung durch radikalen Sauerstoff ist also umkehrbar.“
Die Proteinforscher haben damit entdeckt, dass Get3 zu einer besonders faszinierenden Gruppe von Proteinen gehört: Diese haben im Laufe der Evolution neben ihrer eigentlichen Funktion eine zweite Aufgabe übernommen, die von der ersten oft völlig verschieden ist. Je nach Bedarf können sie die eine oder andere Tätigkeit übernehmen. „Leiden die Zellen unter oxidativem Stress, verwandelt sich Get3 in ein ATP-unabhängiges Chaperon und hilft durch Sauerstoff geschädigten Proteinen. Ist der Stress überwunden, kehrt es wieder zu seiner ursprünglichen Tätigkeit zurück. Als Rettungsassistent arbeitet es sozusagen im Nebenjob“, sagt Blanche Schwappach. „Durch seine Verwandlungskunst befreit Get3 die Zelle so aus dem Dilemma, dass der radikale Sauerstoff ihr eigentliches Rettungssystem aushebelt.“
WEITERE INFORMATIONEN:
Universitätsmedizin Göttingen, Georg-August-Universität
Institut für Molekularbiologie und Göttinger Zentrum für Molekulare Biowissenschaften (GZMB)
Prof. Dr. Blanche Schwappach, Telefon 0551 / 39-5962
Humboldtallee 23, 37073 Göttingen
blanche.schwappach@med.uni-goettingen.de
Media Contact
Weitere Informationen:
http://www.universitaetsmedizin-goettingen.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Nanofasern befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…





















