Erfolgreicher recyceln: Proteinqualitätskontrolle in der Zelle
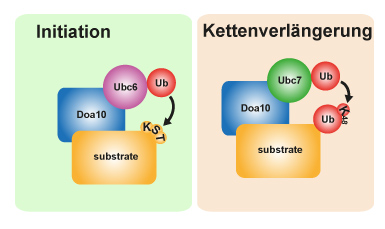
Bei der Initiation wird ein Ubiquitin an einen Aminosäurerest auf dem Zielprotein verknüpft. Für die zum Abbau des Proteins notwendige Kettenverlängerung wird ein weiteres Enzym (Ubc7) benötigt. Grafik: MDC/Annika Weber
Proteine übernehmen in Zellen von Organismen vielfältige Aufgaben. Damit alles reibungslos abläuft, muss die Zelle sicherstellen, dass die Proteine in der nötigen Anzahl und in einwandfreiem Zustand vorliegen. Schadhafte Proteine werden als solche markiert und anschließend recycelt. Zur Erkennung, welche Proteine schadhaft sind, dienen Ligase-Komplexe.
Diese verknüpfen dann auch ein kleines Peptid namens Ubiquitin (Ub) mit den identifizierten Proteinen, um sie als fehlerhaft zu kennzeichnen. Es bedarf jedoch weiterer Schritte, um den Signalweg „Abbau des Proteins“ auszulösen.
So reicht eine Ubiquitinverknüpfung dafür nicht aus, es muss eine spezielle Kette aus mehreren Ub-Molekülen gebildet werden, die an jeweils einer bestimmten Stelle miteinander verknüpft sind. Wie eine solche Kette am Ligase-Komplex Doa10 aufgebaut wird, wurde nun von Annika Weber und Kollegen aus der Arbeitsgruppe von Thomas Sommer am MDC aufgedeckt.
Damit schadhafte Proteine abgebaut werden können, müssen zwei Enzyme aktiv werden
Doa10 spielt eine zentrale Rolle bei der Proteinqualitätskontrolle des Endoplasmatischen Retikulums und des Nukleus und kontrolliert in diesem Prozess eine Vielzahl von verschiedenen Proteinen auf ihren Zustand. Bei der Generierung des Signals zum Proteinabbau verknüpft das Enzym Ubc6 zunächst ein Ubiquitin-Molekül mit dem fehlerhaften Protein.
Ist diese „Initiation“ abgeschlossen, kommt mit Ubc7 ein weiteres Enzym ins Spiel, das die Ausbildung einer homogenen Kette mehrerer Ub-Moleküle veranlasst („Kettenverlängerung“). Sobald die Kette vollständig ist, wird das schadhafte Protein dem Abbauweg zugeführt. Zur Auslösung dieses Signalweges sind also zwei Enzyme notwendig.
Darüber hinaus fand das Forscher-Team heraus, dass in diesem speziellen Prozess das primäre Ubiquitin nicht nur an die Aminosäure Lysin auf dem defekten Protein gekoppelt wird, sondern auch auf Serin-Reste. Solche Aminosäuren-Reste sind die „Andockstellen“ für die Ubiquitinkette auf den Proteinen.
„Damit können auch fehlerhafte Proteine prozessiert werden, die keine zugänglichen Lysin-Reste exponieren, was diesen Abbauprozess besonders flexibel macht. Die Zelle kann dadurch ihre Erfolgsquote bei der Proteinqualitätskontrolle erhöhen“, hebt Annika Weber hervor, eine der beiden Erstautorinnen der Publikation und Doktorandin in der Arbeitsgruppe „Intrazelluläre Proteolyse“ von Thomas Sommer.
Schlägt der Proteinabbau fehl, kann es zu vielfältigen Krankheiten kommen
In einer Zelle müssen sehr viele verschiedene Proteine abgebaut werden – etwa 30 Prozent aller zellulären Proteinstrukturen, die sich durch Faltung von Aminosäureketten bilden, sind schadhaft. Problematisch für die Zelle ist, dass diese fehlerhaft gefalteten Proteine keine homogenen Strukturen aufweisen, sodass eine lückenlose Erkennung erschwert wird.
Schlägt der Abbau solcher „nutzlosen“ Proteine fehl, lagern sie sich in der Zelle ab, die Homöostase bzw. das Gleichgewicht in der Zelle werden gestört. Dies kann bis zum Absterben der Zelle führen und so vielfältige Krankheiten verursachen, zum Beispiel Neurodegenerative Erkrankungen wie Alzheimer und Parkinson.
Annika Weber et al. (2016): „Sequential Poly-ubiquitylation by Specialized Conjugating Enzymes Expands the Versatility of a Quality Control Ubiquitin Ligase“. Molecular Cell. DOI: 10.1016/j.molcel.2016.07.020
Media Contact
Weitere Informationen:
http://www.mdc-berlin.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















