Enzyme des Fettstoffwechsels: Wenn Erreger ihr Fett wegkriegen
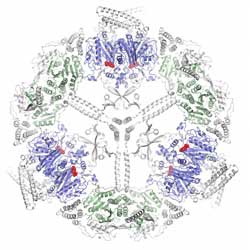
Ein Schnitt durch die Cerulenin-inhibierte Fettsäuresynthase der Hefe zeigt die zentrale hochsymmetrische a-Rad-Struktur. Pro Fettsäuresynthase findet man 6 Ketoacylsynthasen (in blau dargestellt), die von jeweils einem Molekül Cerulenin (in rot) gehemmt werden. Weitere Einheiten der Fettsäuresynthase sind in grün und weiß gezeigt. Mit einem Durchmesser von etwa 25 Nanometer (1nm = 1Tausendstel Mikrometer) gehört die Fettsäuresynthase aus Hefe zu den größten bekannten Enzymstrukturen und erreicht damit die Dimension von Viren. Abbildung: Patrik Johanson/Martin Grininger, MPI für Biochemie <br>
Fettsäuren gehören zu den unverzichtbaren Bausteinen aller lebenden Zellen. Ohne sie könnten die Zellen zum Beispiel keine Membranen bilden und sich auch nicht teilen.
Sie werden von Fettsäuresynthasen hergestellt, was diese Enzyme zu vielversprechenden Zielmolekülen in der Bekämpfung von Krankheitserregern macht. Denn Bakterien und Pilze gehen ohne funktionierende Fettsäuresynthasen zugrunde. Oft aber blockieren Antibiotika mit entsprechender Wirkung auch menschliche Fettsäuresynthasen, die den Enzymen aus Bakterien und Pilzen extrem ähnlich sind.
Ein Forscherteam um Martin Grininger und Dieter Oesterhelt vom Max-Planck-Institut für Biochemie konnte nun erstmals die molekulare Struktur der Fettsäuresynthase aus Hefe während der Hemmung durch ein Antibiotika entschlüsseln. Diese Ergebnisse liefern wichtige Einblicke in die Synthese von Fettsäuren und könnten für die Entwicklung hochspezifischer Antibiotika, wie auch neuartiger Krebstherapeutika genutzt werden. (PNAS, Early Edition, 25.08.2008)
Die Fettsäuresynthese ist einer der Schlüsselwege des zellulären Stoffwechsels. Struktur, Funktion und Hemmung der daran beteiligten Enzyme werden seit Jahrzehnten intensiv erforscht. Blockiert man an der Fettsäuresynthese beteiligte Enzyme, führt das zu einer Verarmung an Fettsäuren und letztlich unweigerlich zum Zelltod. Die Bedeutung der Fettsäuren will man sich nun zunutze machen, um über die gezielte Blockade der Enzyme des Fettsäurestoffwechsels wie zum Beispiel der Fettsäuresynthase von Erregern eine antibiotische Wirkung zu erzielen.
Dabei gibt es aber ein zentrales Problem. „Wie man seit längerem weiß, findet man in der Natur verschiedene Systeme zur Synthese von Fettsäuren. In höheren Organismen etwa gibt es eine Fettsäuresynthase, die sich aus großen multifunktionalen Enzymkomplexen zusammensetzt“, erklärt Grininger. „In den meisten Bakterien findet man diese Funktionseinheiten hingegen als separate Proteine, die für jeweils einen Schritt in diesem komplexen Stoffwechselweg verantwortlich sind. Obwohl wir große Unterschiede im Aufbau und in der Architektur der Fettsäuresynthasen beobachten, ist die Grundstruktur der Enzyme in allen Lebensformen stark konserviert.“ Diese Ähnlichkeit in den Enzymstrukturen macht eine spezifische Blockade der Fettsäuresynthase in Erregern ohne Beeinträchtigung der entsprechenden menschlichen Enzyme, sehr schwierig.
Um die Synthese von maßgeschneiderten Inhibitoren zu ermöglichen und so die spezifische Hemmung von Fettsäuresynthasen zu erreichen, ist es daher wichtig strukturelle Information über diese Enzym-Inhibitor-Komplexe zu gewinnen. Patrik Johansson und Martin Grininger gelang es mit ihren Kollegen am Martinsrieder Max-Planck-Institut unter Leitung von Dieter Oesterhelt, Fettsäuresynthase aus Hefe mit einem Antibiotikum gemeinsam zu kristallisieren und die Molekülstruktur im Komplex aufzuklären. Hefen werden oft als Modellorganismen bei der Erforschung zellulärer Vorgänge genutzt, weil Hefezellen wie alle Eukaryonten einen Zellkern besitzen und viele Abläufe wie in menschlichen Zellen ablaufen. In der aktuellen Publikation präsentieren die Wissenschaftler jetzt die Struktur einer komplexen Fettsäuresynthase mit dem gebundenen Inhibitor Cerulenin (s. Abb.1).
Die Strukturforscher konnten zeigen, dass Cerulenin im Zentrum des Moleküls die Funktionseinheit Ketoacylsynthase angreift, die bei allen Organismen im Laufe der Evolution erhalten blieb. Damit liefern die Wissenschaftler eine Erklärung, warum Cerulein ein unspezifischer Hemmer von Fettsäuresynthasen ist und in der Medizin als Antibiotikum stärkere Nebenwirkungen hat: Es hemmt auch wichtige Strukturen der menschlichen Fettsäuresynthase.
Vielversprechender für einen medizinischen Einsatz sind spezifische Inhibitoren, die nur die Eigenheiten der bakteriellen Fettsäuresynthase erkennen und so nicht auf das menschliche Gegenstück reagieren. Für zwei Vertreter dieser neuen Generation von spezifischen Antibiotika, konnten die Max-Planck-Forscher jetzt zeigen, dass sie an ganz bestimmten Molekülbereichen binden, die abseits der Cerulenin-Bindestelle liegen und einen Bereich nutzen, der im Laufe der Evolution sehr verändert wurde und variabel ist. Damit liefern die Wissenschaftler eine Erklärung, warum die beiden spezifischen Inhibitoren die bakterielle Fettsäuresynthase blockieren, die menschliche Fettsäuresynthase jedoch unbeeinflusst bleibt.
Mit ihren neuen Ergebnissen, bringen die Martinsrieder Forscher die Forschung an der therapeutischen Hemmung der Fettsäuresynthese um einen wichtigen Schritt weiter. „Wir konnten erstmals eine komplexe Fettsäuresynthase in blockierter Form darstellen. Das erhöht das Wissen um den strukturellen Hintergrund der Synthese von Fettsäuren und ihrer Inhibierung ungemein. Unsere Ergebnisse bilden somit die Basis, um die Fettsäuresynthese als Ziel für Antibiotika weiter zu etablieren“. „Wir werden auch in Zukunft versuchen, neue Ansätze zur Verbesserung der Selektivität von Inhibitoren der Fettsäuresynthasen zu liefern“, so Grininger auf die Frage nach weiteren Forschungsvorhaben.
Weitere Informationen erhalten Sie von:
Dr. Martin Grininger
Max-Planck-Institut für Biochemie
Tel.: +49 89 8578 2382
E-Mail: grininge@biochem.mpg.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Nanofasern befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…





















