Entscheidender Schritt für regenerative Wasserstoffherstellung
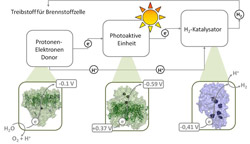
Regenerative Wasserstoffproduktion: Für die regenerative Wasserstoffproduktion benötigt man ein Enzym, das Wasser in Sauerstoff, Protonen und Elektronen spaltet (links, Photosystem II). Die Elektronen wandern weiter zum nächsten Protein (Mitte, Photosystem I), das sie lichtgetrieben weiter zum dritten Protein befördert. Dieses stellt aus Protonen und Elektronen Wasserstoff her (rechts, Hydrogenase). Der so gewonnene Wasserstoff kann als Treibstoff in Brennstoffzellen dienen. Abbildung: Philipp Knörzer<br>
RUB-Forscher haben in Kooperation mit Kollegen der Pennsylvania State University ein biologisches System konstruiert, das mit Lichtenergie effizient Wasserstoff herstellt. Schlüssel zum Erfolg war es, ein lichtaktiviertes Protein und ein wasserstoffproduzierendes Enzym so zu verändern, dass Elektronen effizient von einem zum anderen Protein wanderten.
„Wasserstoff hat ein großes Potential als regenerativer Energieträger“, sagt RUB-Biologe Prof. Dr. Thomas Happe aus der AG Photobiotechnologie. „Derzeit wird aber sämtlicher industriell hergestellter Wasserstoff aus fossilen Energieträgern gewonnen.“ Die Ergebnisse sind in den Zeitschriften Proceedings of the National Academy of Sciences und Journal of Biological Chemistry veröffentlicht.
Drei Elemente für die regenerative Wasserstoffproduktion
Industriell geeignete Katalysatoren für die regenerative Wasserstoffproduktion gibt es nicht, aber die in der Natur vorkommenden Proteine Photosystem II, Photosystem I und Hydrogenase führen genau die dafür erforderlichen Aufgaben aus. Lichtgetrieben spaltet das Photosystem II Wasser in Sauerstoff, Protonen und Elektronen. Die dabei frei werdenden Elektronen leitet es zum Photosystem I, welches – ebenfalls lichtgetrieben – die Elektronen zur Hydrogenase transportiert. Dieses Enzym setzt Elektronen und Protonen zu Wasserstoff um. „Allerdings gibt es nur wenige Organismen, die natürlicherweise alle drei Proteinkomplexe vereinen“, erklärt Dr. Philipp Knörzer von der RUB. „In allen ist der Elektronentransfer vom Photosystem I auf die Hydrogenase sehr ineffizient.“ Genau an dieser Stelle setzten die Forscher an.
Künstliches System effizienter als Natur
Damit Elektronen effizient vom Photosystem I zur Hydrogenase fließen, koppelten die Forscher beide Proteine über ein kurzes organisches Molekül (Dithiol), den so genannten Linker. In beiden Proteinen mutierten sie zunächst gezielt eine Aminosäure im elektronenleitenden Bereich, um eine Bindestelle für den Linker zu schaffen. Hydrogenase, Photosystem I und Linker bildeten anschließend spontan einen Komplex, wenn die Forscher sie zusammengaben. In dem Komplex maßen sie einen Transfer von 105 Elektronen pro Sekunde; ohne Linker fand kein messbarer Elektronenfluss statt. „Die Elektronenleitung ist extrem schnell“, erklärt Happe, „schneller als bei der natürlichen Photosynthese in Pflanzen. Man würde denken, dass ein biologisches System, das sich über Jahrmillionen entwickelt hat, nicht noch zu verbessern ist.“
System mit wirtschaftlich interessanter Leistung
Bereits in früheren Studien testete Happes Team Linker, um Elektronen zwischen Photosystem I und Hydrogenase zu leiten. In den letzten zwei Jahren variierten die Biologen verschiedene Parameter, wie etwa die Länge des Moleküls, und optimierten so den Linker. „Dadurch ist die Wasserstoffproduktion 70 bis 80 mal höher als in früheren Versuchen. Außerdem produzierte das künstliche System stabil Wasserstoff über einen Zeitraum von drei Monaten“, sagt Happe. „Da kommen wir schon in den wirtschaftlich interessanten Bereich.“ Zurzeit ist die Wasserstoffproduktion noch von einem Zusatzstoff (Ascorbat) abhängig, der die notwendigen Elektronen liefert. Um Wasserstoff komplett regenerativ aus Wasser herzustellen, muss das System in Zukunft noch um das Protein Photosystem II erweitert werden. Das Forschungsprojekt wird von der VolkswagenStiftung unterstützt.
Was Mutationen einzelner Aminosäuren bewirken
Auch in einem anderen Projekt wandte Happes Team die so genannte „single site-directed“-Mutagenese auf die Hydrogenase an. Die Forscher mutierten einzelne DNA-Bausteine, um im Protein eine einzige Aminosäure auszutauschen. Im Journal of Biological Chemistry zeigten sie, was die winzigen Änderungen bewirken. Das katalytische Zentrum der Hydrogenase, an dem die Wasserstoffproduktion erfolgt, besteht aus Eisen- und Schwefelatomen und wird H-Cluster genannt. Die Mutation einzelner Aminosäuren in der unmittelbaren Umgebung des H-Clusters störte die Struktur des Enzyms nicht maßgeblich; der Cluster blieb am Protein gebunden. Dennoch verlor das Enzym seine Fähigkeit, Wasserstoff zu produzieren. „Diese Aminosäuren sind wahrscheinlich direkt am katalytischen Mechanismus des Enzyms beteiligt und die Wasserstoffbildung ist komplizierter als man bisher vermutet hat“, erzählt Happe.
Titelaufnahmen
C.E. Lubner, A.M. Applegate, P. Knörzer, A. Ganagoc, D.A. Bryant, T. Happe, J.H. Golbeck (2011): Solar hydrogen-producing bionanodevice outperforms natural photosynthesis, PNAS, doi: 10.1073/pnas.1114660108
P. Knörzer, A. Silakov, C.E. Foster, F.A. Armstrong, W. Lubitz, T. Happe (2012): Importance of the protein framework for catalytic activity of [FeFe]-Hydrogenases, The Journal of Biological Chemistry, doi: 10.1074/jbc.M111.305797
Weitere Informationen
Prof. Dr. Thomas Happe, AG Photobiotechnologie, Fakultät für Biologie und Biotechnologie der Ruhr-Universität, 44780 Bochum, Tel.: 0234/32-27026
thomas.happe@rub.de
Dr. Philipp Knörzer, AG Photobiotechnologie, Fakultät für Biologie und Biotechnologie der Ruhr-Universität, 44780 Bochum, Tel.: 0234/32-24496
philipp.knoerzer@rub.de
Angeklickt
AG Photobiotechnologie
http://www.ruhr-uni-bochum.de/pbt/
Redaktion
Dr. Julia Weiler
Media Contact
Weitere Informationen:
http://www.ruhr-uni-bochum.de/pbt/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Erstmals 6G-Mobilfunk in Alpen getestet
Forschende der Universität Stuttgart erzielen leistungsstärkste Verbindung. Notrufe selbst in entlegenen Gegenden absetzen und dabei hohe Datenmengen in Echtzeit übertragen? Das soll möglich werden mit der sechsten Mobilfunkgeneration – kurz…

Neues Sensornetzwerk registriert ungewöhnliches Schwarmbeben im Vogtland
Das soeben fertig installierte Überwachungsnetz aus seismischen Sensoren in Bohrlöchern zeichnete Tausende Erdbebensignale auf – ein einzigartiger Datensatz zur Erforschung der Ursache von Schwarmbeben. Seit dem 20. März registriert ein…

Bestandsmanagement optimieren
Crateflow ermöglicht präzise KI-basierte Nachfrageprognosen. Eine zentrale Herausforderung für Unternehmen liegt darin, Über- und Unterbestände zu kontrollieren und Lieferketten störungsresistent zu gestalten. Dabei helfen Nachfrage-Prognosen, die Faktoren wie Lagerbestände, Bestellmengen,…





















