Energiesparwunder: das Chaperon-Protein Hsp90 nutzt thermische Fluktuationen, um ATP zu sparen

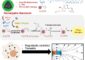
Versuchsaufbau zur simultanen Untersuchung von Faltungsvorgängen und ATP-Bindung. Foto: Christoph Ratzke / TU München<br>
Bisher nahm man an, dass die Chaperone für die dafür nötigen Konformationsänderungen Energie in Form des universellen, zellulären Energieträgers ATP benötigen.
Ein Team von Biophysikern um Thorsten Hugel, Professor an der Technischen Universität München (TUM) und Mitglied des Exzellenzclusters Nanosystems Initiative Munich (NIM), konnte nun zeigen, dass die Scherenbewegung des Chaperons Hsp90 kein ATP verbraucht sondern durch thermische Fluktuation angetrieben wird. Über ihre Ergebnisse berichtet das Fachjournal PNAS in seiner aktuellen Ausgabe.
ATP ist der Hauptenergieträger der meisten Organismen. Die Verbindung wird durch sogenannte ATPasen gespalten, um mit der dabei frei werdenden Energie beispielsweise Muskeln zu bewegen oder Nährstoffe zu transportieren. Das in großen Mengen in den Zellen vorkommende Chaperon-Protein Hsp90 besitzt in jeder seiner beiden Untereinheiten solch eine ATPase. Bisher gingen die Fachleute daher davon aus, dass die Bewegung und die Konformationsänderungen des HSP90 unmittelbar mit der Bindung oder Hydrolyse von ATP zusammenhängen.
Um diese Annahme näher zu untersuchen, haben der Biophysiker Thorsten Hugel und seine Mitarbeiter einen besonderen Versuchsaufbau entwickelt: Mit Hilfe von drei unterschiedlichen Lasern und einer äußerst empfindlichen Kamera konnten die Wissenschaftler die Bindung von ATP und die Konformationsänderungen des Hsp90-Proteins gleichzeitig beobachten. Entgegen ihrer Erwartung zeigten die Experimente, dass Bindung und Hydrolyse von ATP nicht direkt mit den umfassenden Konformationsänderungen des Chaperon-Proteins Hsp90 zusammenhängen. Hsp90 ist vielmehr ein sehr variables System, das durch thermische Fluktuationen angetrieben wird.
„Thermische Fluktuationen, das sind zufällige Änderungen der Struktur des Proteins – man kann sie sich als Zusammenstöße mit Wassermolekülen in der Umgebung vorstellen, die sich bei den Temperaturen in einem lebenden Organismus recht heftig bewegen,“ erklärt Thorsten Hugel. „Indem es diese Zusammenstöße nutzt, um zwischen den verschiedenen Konformationen hin und her zu schalten, spart das Hsp90 wertvolles ATP.“ Doch welche Aufgabe hat dann die ATPase im Hsp90-Chaperon? Die Wissenschaftler vermuten, dass Co-Chaperone oder auch Substratproteine das System so verändern, dass ATP-Bindung oder Hydrolyse eine wesentliche Aufgabe übernehmen.
Mit dem neu entwickelten Versuchsaufbau ist es jetzt möglich, das sehr komplexe System eingehender zu untersuchen und diese wichtige Frage zu lösen. Die Münchner Biophysiker eröffnen damit eine neue Sichtweise auf die Energieumwandlung in molekularen Maschinen.
Die Arbeiten wurden unterstützt aus Mitteln der DFG (Hu997/9-1, SFB 863) und des Exzellenzclusters Nanosystems Initiative Munich (NIM) sowie des NanoBio-Technologie Programms des Elitenetzwerks Bayern.
Originalpublikation:
Heat shock protein 90’s mechano-chemical cycle is dominated by thermal fluctuations. Christoph Ratzke, Felix Berkemeier and Thorsten Hugel,
PNAS, January 3, 2012 vol. 109, no. 1, 161–166) – Doi: 10.1073/pnas.1107930108
Kontakt:
Prof. Dr. Thorsten Hugel
Technische Universität München
Fachgebiet Molekulare Maschinen
James-Franck-Str. 1
85748 Garching, Germany
Tel: +49 89 289 16781
E-Mail: thugel@mytum.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Merkmale des Untergrunds unter dem Thwaites-Gletscher enthüllt
Ein Forschungsteam hat felsige Berge und glattes Terrain unter dem Thwaites-Gletscher in der Westantarktis entdeckt – dem breiteste Gletscher der Erde, der halb so groß wie Deutschland und über 1000…

Wasserabweisende Fasern ohne PFAS
Endlich umweltfreundlich… Regenjacken, Badehosen oder Polsterstoffe: Textilien mit wasserabweisenden Eigenschaften benötigen eine chemische Imprägnierung. Fluor-haltige PFAS-Chemikalien sind zwar wirkungsvoll, schaden aber der Gesundheit und reichern sich in der Umwelt an….

Das massereichste stellare schwarze Loch unserer Galaxie entdeckt
Astronominnen und Astronomen haben das massereichste stellare schwarze Loch identifiziert, das bisher in der Milchstraßengalaxie entdeckt wurde. Entdeckt wurde das schwarze Loch in den Daten der Gaia-Mission der Europäischen Weltraumorganisation,…