Einblick in die elektrische Signalübertragung in Nervenzellen

Forscher der Universität Zürich haben jetzt die erste detaillierte Struktur eines Neurotransmitter-Rezeptors im geöffneten Zustand entschlüsselt. Zusammen mit der vor kurzem bestimmten Struktur eines geschlossenen Kanals erlaubt die Arbeit den ersten detaillierten Einblick in einen grundlegenden Mechanismus der elektrischen Signalübertragung. Die Studie von Prof. Raimund Dutzler erscheint in der Online-Ausgabe des Wissenschaftsmagazins „Nature“.
Ionenkanäle sind die elektrischen Schalter unserer Zellen. Sie ermöglichen den kontrollierten Fluss von geladenen Ionen durch die Zellmembran. Dieser Vorgang bildet die Grundlage für alle elektrisch gesteuerten Prozesse von der Nervenreizleitung bis zur Muskelbewegung. Um diese komplexen Prozesse zu ermöglichen, muss der Ionenfluss gesteuert werden. Deshalb können Ionenkanäle durch Signale kontrolliert geöffnet und geschlossen werden. Verschiedene Neurotransmitter-Rezeptoren in den Synapsen der Nervenzellen sind Teil einer Proteinfamilie von ligandenabhängigen Ionenkanälen.
In Abwesenheit des Neurotransmitters sind diese Kanäle geschlossen und versperren den Ionen den Weg durch die Membran. Werden jedoch bestimmte Neurotransmitter freigesetzt, binden diese an den Rezeptor, worauf sich der Kanal öffnet und bestimmten Ionen erlaubt, durch die Membran zu fliessen. Der Proteinfamilie gehören unter anderem Acetylcholin- und GABA-Rezeptoren an, deren Fehlfunktion zu schweren Nerven- und Muskelkrankheiten führt und die wichtige Angriffspunkte für Medikamente sind.
„Um die Funktionsweise dieser Neurotransmitter-Rezeptoren zu verstehen, müssen wir ihre dreidimensionalen Strukturen im geschlossenen sowie im offenen Zustand kennen“, erklärt Prof. Raimund Dutzler. Vor acht Monaten stellte er und seine Arbeitsgruppe am Biochemischen Institut der Universität Zürich die erste detaillierte Struktur eines geschlossenen Rezeptors vor. Obwohl diese Struktur den Bauplan dieser Proteinfamilie zeigte, war es unmöglich, anhand einer Struktur auf den Mechanismus des Öffnens und des selektiven Ionenflusses zu schliessen. Nun ist es der Gruppe gelungen, die Struktur eines verwandten Ionenkanals im offenen Zustand mithilfe der Röntgenstrukturanalyse aufzuklären.
Wie bei der vorhergehenden Studie haben sich die Wissenschaftler naher bakterieller Verwandter von Neurotransmitter-Rezeptoren bedient. „Die beiden Strukturen stammen zwar von verschiedenen Kanälen, die Proteine sind aber ähnlich genug, um die strukturelle Veränderung beim Öffnen der Pore nachvollziehen zu können“, erklärt Prof. Dutzler. Die Strukturen und Funktionsmechanismen innerhalb einer Proteinfamilie sind dabei so konserviert, dass von den Strukturen dieser bakteriellen Proteine auch auf ihre humanen Verwandten geschlossen werden kann.
„Das Ergebnis der Untersuchung ist unerwartet“, so Dutzler. „Es zeigt einen Öffnungsmechanismus, der dem traditionellen Bild dieses Prozesses widerspricht.“ Beim Öffnen bewegen sich die Teile des Proteins, die den Kanal bilden, als starre Einheit. Da das Protein aus fünf gleichen Untereinheiten besteht, die die gleichen Bewegungen ausführen, öffnet sich der Kanal ähnlich einer aufblühenden Knospe. Die Bewegungen sind dabei viel grösser als erwartet, jedoch steht die Struktur im Einklang mit den Ergebnissen jahrzehntelanger experimenteller Forschung.
Laut Prof. Dutzler erlauben die beiden Strukturen Einblick in einen Mechanismus, der nun von neuen Experimenten bestätigt werden muss. Er ist überzeugt, dass die gewonnen Erkenntnisse Eingang in die Lehrbücher finden und für die Entwicklung neuer Medikamente von Neurotransmitter-Rezeptoren von grosser Bedeutung sein werden.
Ricarda J. C. Hilf & Raimund Dutzler, Structure of a potentially open state of a proton-activated pentameric ligand-gated ion channel, Nature, doi:10.1038/nature07461
Kontakt:
Prof. Raimund Dutzler, Biochemisches Institut, Universität Zürich
Tel. +41 44 635 65 50
E-Mail: dutzler@bioc.uzh.ch
Media Contact
Weitere Informationen:
http://www.uzh.ch/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…

Wenn Immunzellen den Körper bewegungsunfähig machen
Weltweit erste Therapie der systemischen Sklerose mit einer onkologischen Immuntherapie am LMU Klinikum München. Es ist ein durchaus spektakulärer Fall: Nach einem mehrwöchigen Behandlungszyklus mit einem immuntherapeutischen Krebsmedikament hat ein…
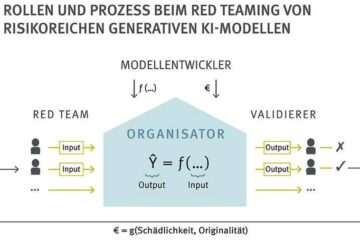
So soll risikoreiche generative KI geprüft werden
Die beschlossene KI-Verordnung der EU sieht vor, dass Künstliche-Intelligenz-Modelle (KI) „für allgemeine Zwecke mit systemischem Risiko“ besonders strikt überprüft werden. In diese Modellkategorie gehören auch populäre generative KI-Modelle wie GPT4…





















