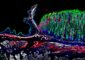
Ein toxischer Verwandlungskünstler

A. hydrophila-Bakterien (blau) setzen Aerolysin frei (grün). Das Toxin macht mehrere Verwandlungen durch, die es ihm ermöglichen, die Zellwand zu durchdringen und so die Zelle zu zerstören. Grafik: Nuria Cirauqui, Universidade Federal do Rio de Janeiro.
Pathogene Bakterien produzieren eine Vielzahl von Toxinen, um ihre Wirte anzugreifen. Einige dieser Gifte werden auch als potenzielle Bioterrorismus-Waffen eingestuft. Ein besonders effizientes Toxin kann Löcher in die Membran von Wirtszellen bohren und diese so zerstören. Dieses sogenannte porenbildende Toxin findet sich in einer Vielzahl von Bakterien.
Bakterien der Gattung Aeromonas hydrophila produzieren ein porenbildendes Toxin namens Aerolysin. Indem diese Bakterien Zellen in der Darmschleimhaut ihres Wirts angreifen – oder Zellen, die sich an der Oberfläche einer offenen Wunde befinden – können sie sich mittels Aerolysin vom Inhalt der zerstörten Zellen ernähren und noch tiefer in den menschlichen Körper eindringen. Als Folge von zerstörten Darmschleimhaut-Zellen leiden Patienten unter schwerer Diarrhöe. A. hydrophila kann auch schwere Wundinfektionen und Blutvergiftung beim Menschen auslösen.
Nebst ihrer pathogenen Funktion sind Aerolysin und andere porenbildende Toxine für die Forschung wegen einer aussergewöhnlichen Eigenschaft interessant: Sie werden vom Bakterium als wasserlösliche Proteine abgesondert, die sich dann ineinanderfügen und in die Membran der Wirtszelle eindringen, um sich dort in ein Membranprotein zu verwandeln.
Der Mechanismus, der dem Toxin diese Verwandlung ermöglicht, war bislang unbekannt und wird rege erforscht. Nun ist es einer internationalen Gruppe von Molekuarbiologen unter Führung der Universität Bern und mit Beteiligung der EPFL gelungen, die atomare Struktur von Aerolysin vor, während und nach dem Eindringen in die Zellmembran zu entschlüsseln. Durch die Erkenntnisse lässt sich die Funktion einer grossen Kategorie von Toxinen deutlich besser verstehen. Die Studie wurde nun im Journal «Nature Communications» publiziert.
Zerstörung der Zelle in vier Schritten
«Aerolysin ist ein sehr stabiles Toxin», sagt Prof. Benoît Zuber vom Institut für Anatomie der Universität Bern, der das Projekt zusammen mit Dr. Ioan Iacovache vom selben Institut leitete. «Diese Stabilität des Toxins beruht auf seiner ungewöhnlichen Kernstruktur, welche wir als doppelkonzentrisches Beta-Fass bezeichnen». Diese verunmöglicht es der Wirtszelle, den Schaden zu reparieren, der aus dem porenbildenden Aerolysin entsteht. «Dies ist auch der Grund, weshalb Aerolysin-ähnliche Toxine zu den wirksamsten porenbildenden Toxinen gehören, die wir kennen», sagt Zuber.
In einem ersten Schritt dockt das wasserlösliche Toxin mit seiner speziellen Kernstruktur an der Zelloberfläche an. In einem zweiten Schritt wandelt sich ein Teil des Proteins um und bildet einen molekularen Pfeilbogen. Dann kollabiert das Toxin, wodurch der Pfeil in die Zelle geschossen wird – und dabei einen molekularen Tunnel durch die Membran öffnet. Schlussendlich biegt sich die Spitze des Pfeils zu einem Haken und verankert so das Toxin fest in der Membran. «Aerolysin kann sich transformieren wie ein Verwandlungskünstler», sagt Zuber. «Diese Wandlungen zu verstehen, wird sehr nützlich sein, um neue und wirksamere Therapien gegen Aeromonas-verursachte Krankheiten zu entwickeln», ergänzt Iacovache.
Wichtig für die DNA-Analyse und die Erforschung von Krankheitsursachen
Wie wegweisende Forschungsergebnisse von anderen Gruppen im Bereich der Nanotechnologie gezeigt haben, kann Aerolysin auch als sehr leistungsfähiges Werkzeug eingesetzt werden, um DNA zu sequenzieren. Zudem wird vermutet, dass bestimmte Proteine unter speziellen Bedingungen eine ähnliche Struktur wie die beschriebene Aerolysin-Struktur bilden. Diese Proteine gehören zu den Auslösern der Alzheimer-Krankheit.
Proteine in atomarer Auflösung sichtbar machen
Mit der Einführung einer neuen Generation von Digitalkameras für Elektronenmikroskope – den sogenannten Direktelektronen-Detektoren – können Forschende nun seit vier Jahren die Struktur von Proteinen visualisieren und bestimmen, wie deren Atome angeordnet sind. Solche Details konnten zuvor nur mittels zweier Methoden sichtbar gemacht werden, der Röntgenkristallographie und der Kernspinresonanzspektroskopie (NMR). Die erstere benötigt jedoch Kristalle des zu untersuchenden Proteins, was im Fall von Membranproteinen schwierig ist. Die zweite Methode beschränkt sich auf sehr kleine Proteine.
«Die neue Elektronenmikroskopie-Methode ist ein Durchbruch in der Biomedizin – dank ihr konnte die atomare Struktur einer ganzen Reihe von Proteinen entschlüsselt werden», sagt Zuber. Dies wurde unter anderem durch das Journal «Nature» gewürdigt, das die sogenannte Kryoelektronenmikroskopie mit Einzelpartikeln zur Forschungsmethode des Jahres 2015 ernannte. Die Kryo-Elektronenmikroskopie, in der Proben schockgefroren werden, um sie besser abbilden zu können, wurde bereits in den 80er Jahren entwickelt und laufend verbessert – so auch in den 90er Jahren an der Universität Bern. Revolutioniert wurde die Methode schliesslich mit der Einführung der sehr viel präziseren Digitalkameras.
Angaben zum Artikel:
Ioan Iacovache, Sacha De Carlo, Nuria Cirauqui, Matteo Dal Peraro, Gisou van der Goot, Benoît Zuber: Cryo-EM structure of aerolysin variants reveals a novel protein fold and the pore formation process, Nature Communications, 13. Juli 2016, doi: 10.1038/NCOMMS12062
http://www.unibe.ch/aktuell/medien/media_relations/medienmitteilungen/2016/medie…
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue Industrie-4.0-Lösung für niedrigschwelligen Zugang zu Datenräumen
»Energizing a Sustainable Industry« – das Motto der Hannover Messe 2024 zeigt klar, wie wichtig eine gleichermaßen leistungsstarke und nachhaltige Industrie für den Fertigungsstandort Deutschland ist. Auf der Weltleitmesse der…

Quantenpräzision: Eine neue Art von Widerstand
Physikforschende der Universität Würzburg haben eine Methode entwickelt, die die Leistung von Quantenwiderstands-Normalen verbessern kann. Sie basiert auf einem Quantenphänomen namens anomaler Quanten-Hall-Effekt. In der industriellen Produktion oder in der…

Sicherheitslücke in Browser-Schnittstelle erlaubt Rechnerzugriff über Grafikkarte
Forschende der TU Graz waren über die Browser-Schnittstelle WebGPU mit drei verschiedenen Seitenkanal-Angriffen auf Grafikkarten erfolgreich. Die Angriffe gingen schnell genug, um bei normalem Surfverhalten zu gelingen. Moderne Websites stellen…