Ein soziales Netzwerk der menschlichen Proteine
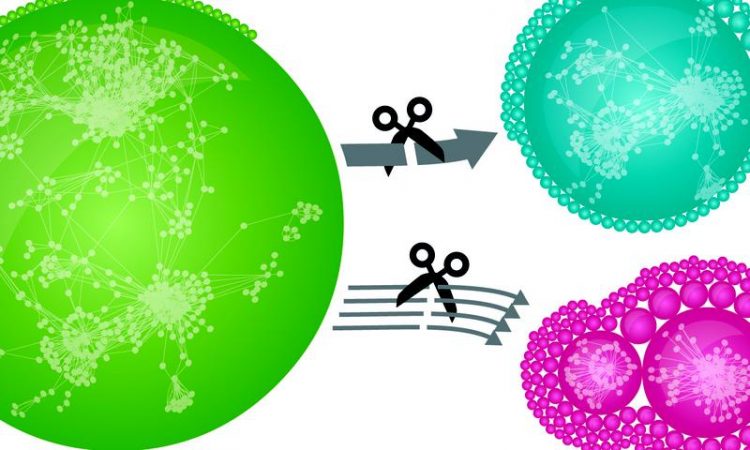
Proteine sind über Interaktionen verknüpft (grün). Das Entfernen starker Interaktionen beeinflusst das Netzwerk kaum (blau), während dieses ohne schwache Interaktionen in Module zerfällt (rot). (c) MPI für Biochemie / Hein & Krause
Wissenschaftlern am Max-Planck-Institut (MPI) für Biochemie in Martinsried und am MPI für Molekulare Zellbiologie und Genetik in Dresden ist es jetzt gelungen, eine detaillierte Karte der menschlichen Proteininteraktionen zu erstellen.
Dank einer speziellen massenspektrometrischen Quantifikationsmethode konnten sie erstmals bestimmen, wie stark jede einzelne der Interaktionen ist. „Dabei zeigte sich, dass die meisten Interaktionen nur schwach, für den Zusammenhalt des Netzwerks jedoch von entscheidender Bedeutung sind“, erklärt Marco Hein, Erstautor der Studie.
Proteine sind die molekularen Grundbausteine und Maschinen der Zelle und an praktisch allen Prozessen des Lebens beteiligt. Ihre Aufgaben verrichten sie unter anderem dadurch, dass sie miteinander interagieren und Netzwerke bilden. Mit Hilfe der quantitativen Massenspektrometrie können Wissenschaftler präzise bestimmen, welche Proteine dabei miteinander wechselwirken.
Die Technik funktioniert wie eine Art molekularer Fischfang: Ein Protein dient als Köder; fischt man es aus einem Proteingemisch heraus, so werden auch seine Interaktionspartner herausgezogen und anschließend im Massenspektrometer identifiziert. In einem großangelegten Projekt haben Martinsrieder und Dresdner Forscher über 1.100 solcher Köder-Proteine analysiert und dabei ein Netzwerk aus insgesamt 5.400 Proteinen erstellt. Diese sind durch 28.000 Interaktionen verknüpft.
Die verschiedenen Interaktionen unterscheiden sich dabei deutlich in ihren Eigenschaften. Einige Bindungen sind stark und zum Beispiel struktureller Natur, andere sind schwach und zeitlich begrenzt, etwa um Informationen in Signalwegen weiterzugeben.
Die Stärke einer Interaktion zu messen ist jedoch sehr aufwändig und war in Hochdurchsatzstudien bisher nicht möglich. Mit ihrem neuen Ansatz können die Forscher die Stärke einer Interaktion jetzt indirekt abschätzen. Dazu messen sie, wie viele Kopien aller Proteine jeweils in der Zelle vorliegen und in welchem Verhältnis die Interaktionspartner an jedem Köder-Protein anbeißen. Je stärker die Bindung zum Köder, desto mehr des jeweiligen Interaktionspartners fischen die Wissenschaftler heraus.
Dank der Studie ergibt sich ein ganz neuer Blickwinkel auf das „soziale Netzwerk“ der menschlichen Proteine. Forscher können im nun erstellten Katalog nicht nur nachschlagen, wer mit wem interagiert, sondern gleichzeitig verschiedene Arten von Proteininteraktionen unterscheiden. Es zeigt sich, dass schwache Interaktionen die Mehrheit im Netzwerk darstellen.
„Für sich allein mag eine einzelne schwache Bindung unwichtig erscheinen, in der Summe jedoch bilden diese Interaktionen das Rückgrat, das das Netzwerk zusammenhält“, erläutert Marco Hein. „Eine Eigenschaft, die das Netzwerk der Proteine mit dem zwischenmenschlichen Netzwerk unserer Gesellschaft gemein hat.“ [AK]
Originalpublikation:
M.Y. Hein, N.C. Hubner, I. Poser, J. Cox, N. Nagaraj, Y. Toyoda, I.A. Gak, I. Weisswange, J. Mansfeld, F. Buchholz, A.A. Hyman & M. Mann: “A human interactome in three quantitative dimensions organized by stoichiometries and abundances”. Cell, Oktober 2015
DOI: 10.1016/j.cell.2015.09.053
Kontakt:
Prof. Dr. Matthias Mann
Proteomics und Signaltransduktion
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
E-Mail: mmann@biochem.mpg.de
Dr. Christiane Menzfeld
Öffentlichkeitsarbeit
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
Tel. +49 89 8578-2824
E-Mail: pr@biochem.mpg.de
http://www.biochem.mpg.de – Webseite des Max-Planck-Institutes für Biochemie
http://www.biochem.mpg.de/mann – Webseite der Abteilung von Matthias Mann
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Anlagenkonzepte für die Fertigung von Bipolarplatten, MEAs und Drucktanks
Grüner Wasserstoff zählt zu den Energieträgern der Zukunft. Um ihn in großen Mengen zu erzeugen, zu speichern und wieder in elektrische Energie zu wandeln, bedarf es effizienter und skalierbarer Fertigungsprozesse…

Ausfallsichere Dehnungssensoren ohne Stromverbrauch
Um die Sicherheit von Brücken, Kränen, Pipelines, Windrädern und vielem mehr zu überwachen, werden Dehnungssensoren benötigt. Eine grundlegend neue Technologie dafür haben Wissenschaftlerinnen und Wissenschaftler aus Bochum und Paderborn entwickelt….

Dauerlastfähige Wechselrichter
… ermöglichen deutliche Leistungssteigerung elektrischer Antriebe. Überhitzende Komponenten limitieren die Leistungsfähigkeit von Antriebssträngen bei Elektrofahrzeugen erheblich. Wechselrichtern fällt dabei eine große thermische Last zu, weshalb sie unter hohem Energieaufwand aktiv…





















